题目内容
14.A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5.(1)C的原子结构示意图为
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键类型为离子键、非极性共价键;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程
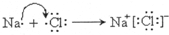 .
.(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(4)A、B、D、E的离子半径由大到小的顺序为:S2->Cl->Na+>Al3+;C、D、E的气态氢化物的稳定性顺序为:HCl>H2S>SiH4(请用化学用语填写,上同).
(5)工业上将干燥的E单质通人D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为2S2Cl2﹢2H2O=3S+SO2↑+4HCl.
分析 A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是钠元素,B是地壳中含量最高的金属元素,则B是铝元素,C单质的晶体是良好的半导体材料,则C为硅元素,D的最外层电子数与内层电子数之比为3:5,则D为硫元素,则E为氯元素,F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应为铝热反应,则F为铁元素,以此解答该题.
解答 解:A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是钠元素,B是地壳中含量最高的金属元素,则B是铝元素,C单质的晶体是良好的半导体材料,则C为硅元素,D的最外层电子数与内层电子数之比为3:5,则D为硫元素,则E为氯元素,F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应为铝热反应,则F为铁元素,
(1)C为硅元素,C的原子结构示意图为  ,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,
,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,
故答案为: ;第3周期,第VIA族;
;第3周期,第VIA族;
(2)钠单质在氧气中燃烧生成化合物甲为过氧化钠,甲中所含化学键为离子键、非极性共价键;钠单质在氯气中燃烧生成化合物乙为氯化钠,用电子式表示乙的形成过程为 ,
,
故答案为:离子键、非极性共价键; ;
;
(3)铝单质与氧化铁在高温条件下反应是冶炼铁的方法之一,该反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)A、B、D、E形成的简单离子分别为:Na+、Al3+、S2-、Cl-,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->Na+>Al3+,非金属性Cl>S>Si,元素的非金属性越强,对应的气态氢化物的稳定性越强,为HCl>H2S>SiH4,
故答案为:S2->Cl->Na+>Al3+;HCl>H2S>SiH4;
(5)工业上将干燥的E单质通人D熔融的单质中可制得化合物为S2Cl2,该物质可与水反应生成一种能使品红溶液褪色的气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,则1molS2Cl2参加反应要转移1.5mol电子,其中只有一种元素化合价发生改变,则应为硫元素的化合价在改变,该反应的化学方程式为2S2Cl2﹢2H2O=3S+SO2↑+4HCl,
故答案为:2S2Cl2﹢2H2O=3S+SO2↑+4HCl.
点评 本题考查结构性质位置关系应用,为高考常见题型和高频考点,侧重于学生的分析能力考查,推断元素是解题关键,注意常见元素的自然存在以及元素的性质和基础知识的掌握.

| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: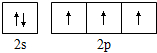 | ||
| C. | CO2的比例模型: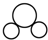 | D. | Cl-的结构示意图: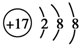 |
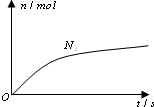 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 113号元素属于过渡元素 |
①减小容器体积使增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥降低温度.
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①③⑥ |
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
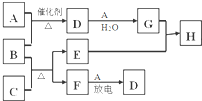 下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题:
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题: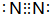 .
.