题目内容
5.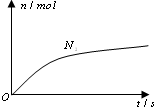 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
分析 由曲线变化图可知,随反应进行N2的物质的量增大,故N2是生成物,则NH4+应是反应物,N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:方程式为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,
A.反应生成H+,溶液酸性增强,故A正确;
B.N元素化合价由-3价升高到0价,则消耗1mol还原剂,转移3mol电子,故B错误;
C.由方程式可知氧化剂和还原剂的物质的量之比为3:2,故C错误;
D.由方程式可知反应的还原剂为NH4+,故D错误.
故选A.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
15.有关说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
16.S2Cl2在合成橡胶、硬水软化等方面有着重要应用.将Cl2通入熔融的硫黄可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊.有关叙述正确的是( )
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
13.已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl反应,则下列说法正确的是( )
| A. | 该反应中电子转移数为6 | B. | 生成的氯气式量约为73.3 | ||
| C. | KCl中既有35Cl,又有37Cl | D. | KCl中只含35Cl |
20.下列说法正确的是( )
| A. | 金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体 | |
| B. | 铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体 | |
| C. | 过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+ | |
| D. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
17.已知乙炔、苯、乙醛的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
| A. | 84% | B. | 60% | C. | 91% | D. | 无法计算 |
15.下列叙述正确的是( )
| A. | 可用分液漏斗分离溴和四氯化碳 | |
| B. | CH3COOCH3核磁共振氢谱中只给出一种信号 | |
| C. | 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为碳链异构体 | |
| D. | 与氢气加成得到2,3-二甲基戊烷的烯烃结构式有5种 |
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.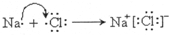 .
.