题目内容
4.下列化学用语的表述不正确的是( )| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: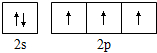 | ||
| C. | CO2的比例模型: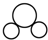 | D. | Cl-的结构示意图: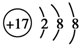 |
分析 A、过氧化氢中O分别与O和H形成共价键;
B、根据洪特规则:电子排布在同一能级的不同轨道时优先单独占据一个轨道,且自旋方向相同;泡利原理:一个原子轨道里最多可容纳2个电子,且自旋方向相反;
C、二氧化碳为直线形分子,据此判断;
D、Cl的原子序数为17,得到1个电子后形成最外层8个电子的稳定结构,据此解答即可.
解答 解:A、过氧化氢中O分别与O和H形成非极性共价键和极性共价键,结构式为H-O-O-H,故A正确;
B、由洪特规则和泡利原理可知,态氮原子L层电子的轨道表示式为 ,故B正确;
,故B正确;
C、二氧化碳为直线形分子,比例模型为 ,故C错误;
,故C错误;
D、Cl的原子序数为17,得到1个电子后形成最外层8个电子的稳定结构,Cl-的结构示意图: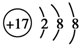 ,故D正确,故选C.
,故D正确,故选C.
点评 本题主要考查的是常见化学用语表达,熟练掌握结构式、球棍模型、离子结构示意图等是关键,难度不大.

练习册系列答案
相关题目
7.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
15.有关说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
12.常温下,稀释0.1mol•L-1CH3COONa溶液,如图中的纵坐标可以表示( )
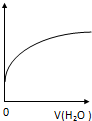

| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
19.“南孚”牌镍氢充电电池的某极是储氢合金X(合金X结合氢气的形式表示为XH6),另一电极为NiOOH/Ni(OH)2,电解质为强碱溶液,其总反应式为:XH6+6NiOOH$?_{充电}^{放电}$X+6Ni(OH)2.下列说法正确的是( )
| A. | 充电时电源的正极应与电池的X极相连 | |
| B. | 放电时负极电极反应式为:XH6+6e-═X+6H+ | |
| C. | 充电时阳极电极反应式为:6Ni(OH)2+6OH-═6NiOOH+6H2O+6e- | |
| D. | 该电池放电反应1 mol XH6时,若用于电解水,理论上可得到16g氧气 |
9.已知X、Y为第三周期非金属元素(稀有气体除外),且电负性X>Y,下列说法错误的是( )
| A. | X与Y形成化合物时,X可能显负价,也可能显正价 | |
| B. | 第一电离能X可能小于Y | |
| C. | X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 | |
| D. | 原子序数X一定大于Y |
16.S2Cl2在合成橡胶、硬水软化等方面有着重要应用.将Cl2通入熔融的硫黄可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊.有关叙述正确的是( )
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
13.已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl反应,则下列说法正确的是( )
| A. | 该反应中电子转移数为6 | B. | 生成的氯气式量约为73.3 | ||
| C. | KCl中既有35Cl,又有37Cl | D. | KCl中只含35Cl |
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族. .
.