题目内容
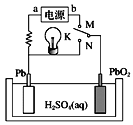
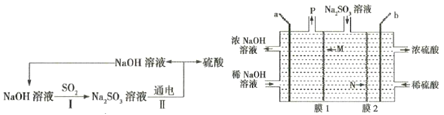
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图。下列说法错误的是( )

A.干电池是一种将化学能转变为电能的装置
B.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
C.酸溶时ZnS作还原剂,操作1为过滤
D.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+
【答案】B
【解析】
A. 干电池是一次电池,能将化学能转变为电能,A正确;
B. 盐酸具有还原性,电离产生的Cl-会被MnO2氧化产生有毒气体Cl2,影响Mn2+的电解,因此不能用盐酸代替硫酸使用,B错误;
C. ZnS、MnO2、H2SO4发生氧化还原反应,产生ZnSO4、MnSO4、S及H2O,ZnS作还原剂,反应中S被氧化产生难溶于水的S单质,ZnSO4、MnSO4溶解在水中,所以操作1是分离难溶性固体与可溶性液体混合物的操作,名称为过滤,C正确;
D. 通电时Mn2+在阳极失去电子被氧化产生MnO2,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,D正确;
故合理选项是B。

练习册系列答案
相关题目