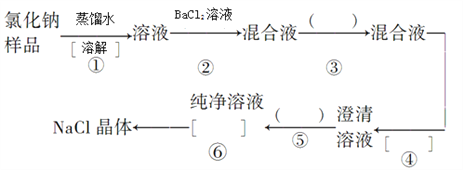
题目内容
【题目】25℃时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( ) 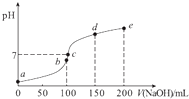
A.a点时溶液的pH<1
B.c点时离子浓度大小顺序为:c(Na+)>c(SO42﹣)>c(NH4+)
C.de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42﹣)
D.a点到b点的过程中,溶液的导电能力增强
【答案】D
【解析】解:A.0.1molL﹣1 NH4HSO4溶液中铵根离子水解溶液氢离子浓度大于0.1mol/L,a点时溶液的pH<1,故A正确; B.c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,b点时c(Na+)=c(SO42﹣),b点时c(Na+)>c(SO42﹣),根据N元素与S元素的关系,可以得出c(SO42﹣)>c(NH4+),故c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+),故B正确;
C.de段上的点氢氧化钠过量,溶液显碱性,溶液中电荷守恒为:c(NH4+)+c(Na+)+c(H+)=2c(SO42﹣)+c(OH﹣),c(OH﹣)>c(H+),c(NH4+)+c(Na+)>2c(SO42﹣),故C正确;
D.b点恰好消耗完H+ , 溶液中只有(NH4)2SO4与Na2SO4 , 溶液中溶质都是强电解质,溶液中离子浓度变化不大,导电性变化不大,故D错误;
故选D.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3﹣、F﹣和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程: 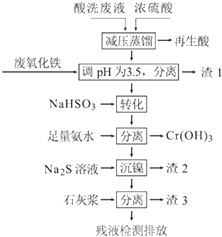
已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3[Ni(NH3)6]2+
(1)再生酸中含有 , 采取减压蒸馏的原因是 .
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是 .
(3)请写出“转化”时NaHSO3与Cr2O72﹣发生反应的离子反应方程式: .
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为: .
(5)滤渣3的主要成分为CaF2、Ca(OH)2和 .
(6)经检测,最后的残液中c(Ca2+)=0.004molL﹣1 , 则残液中F﹣浓度为mgL﹣1 , (填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10﹣11 mol3L﹣3 , 国家排放标准要求氟离子浓度小于10mgL﹣1].