题目内容
【题目】氯化钠样品含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
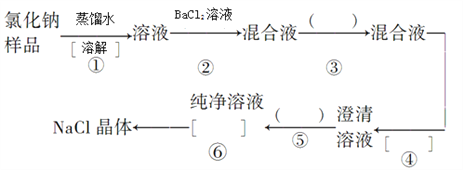
(1)步骤③加入沉淀剂是________;步骤⑤加入足量盐酸作用是________;步骤⑥操作名称__________。
(2)写出有关反应离子方程式
步骤②________________;__________________。
步骤⑤________________________________。
(3)在进行①、④、⑥操作时,都要用到玻璃棒,其作用分别是:步骤④_________________; ⑥________________。
【答案】 Na2CO3溶液 除去过量Na2CO3 蒸发结晶或蒸发 SO42-+Ba2+===BaSO4↓ CO32-+Ba2+===BaCO3↓ CO32-+2H+===H2O+CO2↑ 引流,防止液体流到滤纸外 搅拌,防止液体局部过热,发生液体飞溅
【解析】因为要除去氯化钠晶体中含有少量的Na2SO4和 Na2CO3两种杂质,实质就是除去碳酸根和硫酸根。①根据实验流程,首先要溶于水配制成溶液,溶液中含有碳酸钠,硫酸钠和氯化钠三种物质,②向溶液中加入过量的氯化钡,把溶液中的碳酸根和硫酸根都转化成沉淀,③加入过量的碳酸钠溶液,把第二步中过量的氯化钡除去,这样得到的混合液中含有碳酸钡和硫酸钡沉淀还有碳酸钠和氯化钠溶液,④是过滤操作除去生成的碳酸钡、硫酸钡沉淀,⑤向滤液中加入适量的盐酸,除去过量的碳酸钠溶液,得到纯净的氯化钠溶液,⑥再通过蒸发结晶操作得到纯净的氯化钠晶体。
(1)根据上述分析,步骤③加入沉淀剂是Na2CO3溶液,步骤⑤加入足量盐酸可以除去过量Na2CO3,步骤⑥为蒸发,故答案为:Na2CO3溶液;除去过量Na2CO3;蒸发;
(2)步骤②加入氯化钡溶液,分别与硫酸钠、碳酸钠反应生成硫酸钡、碳酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓、CO32-+Ba2+=BaCO3↓,故答案为:SO42-+Ba2+=BaSO4↓;CO32-+Ba2+=BaCO3↓;
步骤⑤加入适量盐酸,除去溶液中过量的碳酸钠,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,故答案为:CO32-+2H+=H2O+CO2↑;
(3)在进行①、④、⑥操作时,都要用到玻璃棒,其作用分别是:步骤④中是引流,防止液体流到滤纸外;步骤⑥中是搅拌,防止液体局部过热,发生液体飞溅,故答案为:引流,防止液体流到滤纸外;搅拌,防止液体局部过热,发生液体飞溅。

【题目】下列实验中,对应的现象以及原理都不正确的是
选项 | 实验 | 现象 | 原理 |
A. | 向盛有2mLNa2SO4溶液的试管中加入2mLBaCl2溶液。 | 白色沉淀 | Ba2++SO |
B. | 向盛有2mL稀NaOH溶液的试管中加入2mL稀HCl溶液。 | 无现象 | OH-+H+===H2O |
C. | 向盛有2mLCuSO4溶液的试管中加入2mL稀NaOH溶液。 | 蓝色沉淀 | Cu2++2OH-= Cu(OH)2↓ |
D. | 向盛有2mLNa2CO3溶液的试管中加入2mLH2SO4溶液(过量)。 | 无现象 | CO32- + H+ = H2CO3 |
A. A B. B C. C D. D