题目内容
【题目】不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3﹣、F﹣和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程: 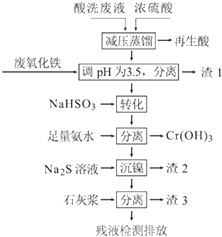
已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3[Ni(NH3)6]2+
(1)再生酸中含有 , 采取减压蒸馏的原因是 .
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是 .
(3)请写出“转化”时NaHSO3与Cr2O72﹣发生反应的离子反应方程式: .
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为: .
(5)滤渣3的主要成分为CaF2、Ca(OH)2和 .
(6)经检测,最后的残液中c(Ca2+)=0.004molL﹣1 , 则残液中F﹣浓度为mgL﹣1 , (填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10﹣11 mol3L﹣3 , 国家排放标准要求氟离子浓度小于10mgL﹣1].
【答案】
(1)硝酸、氢氟酸;降低蒸馏的温度以减少硝酸的分解
(2)实现废物利用,降低生产成本
(3)Cr2O72﹣+3HSO3﹣+5H+=2Cr3++3SO42﹣+4H2O
(4)[Ni(NH3)6]2++S2﹣=NiS↓+6NH3
(5)CaSO4
(6)1.9;符合
【解析】解:酸洗废液中含有Fe3+、Ni2+、NO3﹣、F﹣和+6价铬的含氧酸根离子等,加入浓硫酸减压蒸馏减少硝酸分解,得到再生酸,在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣Ⅰ,滤液中加入NaHSO3与Cr2O72﹣发生反应收藏铬离子,加入足量氨水沉淀铬离子形成氢氧化铬沉淀,过滤后的滤液中加入Na2S沉淀镍,过滤得到滤液中加入石灰浆沉淀得到滤渣3CaF2、Ca(OH)2和CaSO4 , (1)分析可知再生酸是硝酸根离子和难挥发性的浓硫酸反应后生成易挥发性的硝酸,F﹣离子结合氢离子生成弱酸HF,再生酸为HNO3、HF,采取减压蒸馏的原因是降低蒸馏的温度以减少硝酸的分解, 所以答案是:硝酸、氢氟酸;降低蒸馏的温度以减少硝酸的分解;(2)利用废氧化铁(主要成分为Fe3O4)代替烧碱调节pH的好处是废物利用,提高经济效益,降低生产成本,
所以答案是:废物利用,降低生产成本;(3)转化时NaHSO3与Cr2O72﹣发生氧化还原,反应生成铬离子、硫酸根离子和水,反应的离子方程式为:Cr2O72﹣+3HSO3﹣+5H+=2Cr3++3SO42﹣+4H2O,
所以答案是:Cr2O72﹣+3HSO3﹣+5H+=2Cr3++3SO42﹣+4H2O;(4)Ni2+与足量氨水的反应为:Ni2++6NH3[Ni(NH3)6]2+ , 加入Na2S会生成更难溶的NiS,“沉镍”的离子方程式为:[Ni(NH3)6]2++S2﹣=NiS↓+6NH3 ,
所以答案是:[Ni(NH3)6]2++S2﹣=NiS↓+6NH3;(5)分析可知滤渣3为生成的CaF2沉淀,微溶于水的氢氧化钙和硫酸钙,滤渣3的主要成分为CaF2、Ca(OH)2和CaSO4 ,
所以答案是:CaSO4;(6)依据溶度积常数计算F﹣离子浓度,Ksp=c(Ca2+)c(F﹣)2=4×10﹣11 mol3L﹣3 , 残液中c(Ca2+)=0.004molL﹣1 , 则c(F﹣)= ![]() =1×10﹣4mol/L=1×10﹣4mol/L×19g/mol=0.0019g/L=1.9mg/L,依据国家排放标准要求氟离子浓度小于10mgL﹣1分析判断1.9mg/L<10mgL﹣1 , 符合国家标准,
=1×10﹣4mol/L=1×10﹣4mol/L×19g/mol=0.0019g/L=1.9mg/L,依据国家排放标准要求氟离子浓度小于10mgL﹣1分析判断1.9mg/L<10mgL﹣1 , 符合国家标准,
所以答案是:1.9,符合;

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案