题目内容
19.饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:Al+NaNO3+NaOH→NaAlO2+N2↑+H2O.请回答下列问题:①配平方程式并用“双线桥”表示电子转移情况
②上述反应中的氧化产物为NaAlO2.
③上述反应中若生成标况下22.4LN2,则转移的电子的物质的量为10mol.
分析 反应10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目;据此分析判断.
解答 解:(1)反应中铝失去电子数为10×3,NaNO3得到电子数为6×5,所以用“双线桥法”标明反应中电子转移的方向和数目为: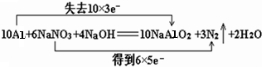 ,
,
故答案为: ;
;
(2)反应10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,则NaAlO2为氧化产物,
故答案为:NaAlO2;
(3)N元素的化合价从+5价降低到0价,所以生成1个氮气转移10个电子,则生成1mol气体转移的电子的物质的量为1mol×2×(5-0)=10mol,;
故答案为:10.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
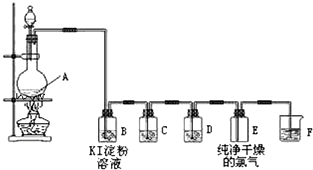
10.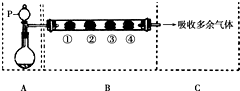 用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
Ⅰ.若在装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中所设计实验,请填写表中空白:
Ⅱ.若在装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.回答下列问题:
(1)P中所盛试剂为浓硫酸.
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式Cl2+2I-=2Cl-+I2;①处包有的某固体物质可能是b.
a.MnO2 b.KMnO4c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到的现象为先变红后褪色.
(4)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:5Cl2+I2+6H2O=12H++2IO3-+10Cl-.
(5)Ⅰ.Ⅱ两实验中尾气均可采用NaOH溶液吸收.(填化学式)
 用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:Ⅰ.若在装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中所设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘 水混合液 | 氢硫酸 |
| 现象 | a | b | 褪色 | 浅黄色 |
| 体现SO2的性质 | c | d | e | f |
(1)P中所盛试剂为浓硫酸.
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式Cl2+2I-=2Cl-+I2;①处包有的某固体物质可能是b.
a.MnO2 b.KMnO4c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到的现象为先变红后褪色.
(4)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:5Cl2+I2+6H2O=12H++2IO3-+10Cl-.
(5)Ⅰ.Ⅱ两实验中尾气均可采用NaOH溶液吸收.(填化学式)
14.下列有关实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1硫酸溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | H2S通入CuSO4溶液中 | 溶液中出现黑色沉淀 | 酸性:H2S>H2SO4溶液 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| D | 将一小块钠投入到CuSO4溶液中 | 有无色无味的气体放出,且出现蓝色沉淀 | 氧化性:H+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
4.化学反应的本质是旧的化学键的断裂和新化学键的形成.已知某些化学键的键能数据如下:
则下列热化学方程式不正确的是( )
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能∕(kJ•mol-1) | 436 | 243 | 431 |
| A. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=+91.5 kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ•mol-1 |
9.下列四个实验装置中,一定没有气体生成的是( )
| A. | 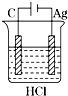 | B. |  | C. | 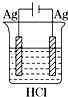 | D. |  |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题: