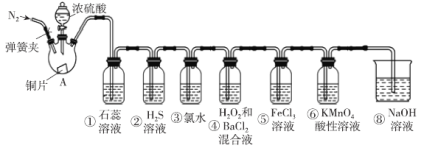
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA
B.1mol重水与1mol水中,中子数比为2:1
C.5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA
D.标准状况下,11.2L二氧化碳与和足量的过氧化钠反应,转移的电子数为0.5NA
【答案】B
【解析】
A.一个甲烷分子由4个C-H键结合成正四面体;
B.重水分子为2H216O,水分子为1H216O;
C.乙烯(C2H4)和环丁烷(C4H8)最简式均为CH2,乙烯(C2H4)和环丁烷(C4H8)的混合气体可以看成是由一定物质的量的CH2组成的,且式量=12+2=14;
D.![]() ,过氧化钠中4个-1价的O有2个升高到0价,2个降低到0价,故与方程式对应的转移电子数为2e-。
,过氧化钠中4个-1价的O有2个升高到0价,2个降低到0价,故与方程式对应的转移电子数为2e-。
A.标准状况下,n(CH4)=![]() =0.1mol,每个CH4分子中含4个C-H键,所以n(碳氢键)=0.1mol×4=0.4mol,所以标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA,A正确;
=0.1mol,每个CH4分子中含4个C-H键,所以n(碳氢键)=0.1mol×4=0.4mol,所以标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA,A正确;
B.重水分子为2H216O,水分子为1H216O,一个2H中中子数=2-1=1,一个H中中子数=1-1=0,一个16O中中子数=16-8=8,所以一个重水分子中中子数=1×2+8=10,一个水分子中中子数=0×2+8=8,所以1mol重水与1mol水中,中子数比为10:8=5:4,B错误;
C.乙烯(C2H4)和环丁烷(C4H8)最简式均为CH2,乙烯(C2H4)和环丁烷(C4H8)的混合气体可以看成是由一定物质的量的CH2组成的,且n(CH2)=![]() =0.4mol,所以n(C)=0.4mol×1=0.4mol,即5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA,C正确;
=0.4mol,所以n(C)=0.4mol×1=0.4mol,即5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA,C正确;
D.标况下,11.2L二氧化碳的物质的量=![]() =0.5mol,由
=0.5mol,由![]() 可知,每2mol二氧化碳反应对应转移2mol电子, 所以0.5mol二氧化碳与和足量的过氧化钠反应,转移的电子的物质的量为0.5mol,即电子数为0.5NA,D正确。
可知,每2mol二氧化碳反应对应转移2mol电子, 所以0.5mol二氧化碳与和足量的过氧化钠反应,转移的电子的物质的量为0.5mol,即电子数为0.5NA,D正确。
答案选B。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
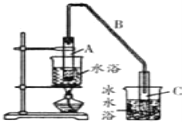
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
【题目】下列实验现象、结论及其推理都正确的是 ( )
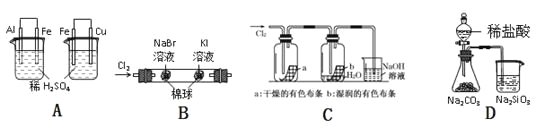
实验 | 实验现象 | 结论 |
A | 左烧杯中铁不断溶解,右烧杯中铁表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | a中布条不褪色,b中布条褪色 | 干燥氯气无漂白性,潮湿的氯气有漂泊性 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D