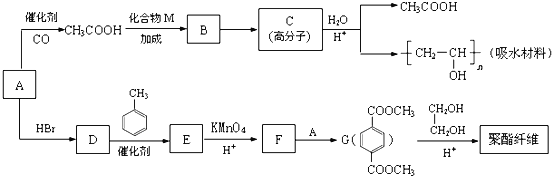
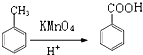题目内容
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
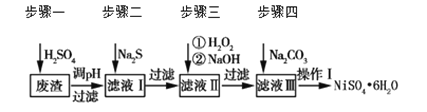
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_______(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式________。
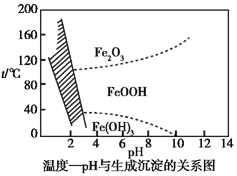
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠![]() (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl![]() +6H+
+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_______。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是_______。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;
②___________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
【答案】加热或搅拌或增大硫酸浓度等 Cu2++S2-![]() CuS↓ cd NiSO4 上层清液呈无色 过滤,并用蒸馏水洗净沉淀 向沉淀中加6 mol·L-1的H2SO4溶液,直至恰好完全溶解
CuS↓ cd NiSO4 上层清液呈无色 过滤,并用蒸馏水洗净沉淀 向沉淀中加6 mol·L-1的H2SO4溶液,直至恰好完全溶解
【解析】
废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去不溶于铁离子,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,再通过调节pH值2~4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体;
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率;
(2)加Na2S,易生成CuS沉淀;
(3)a.根据化合价的代数和为零分析;
b.pH=4,c(OH-)=1×10-10 molL-1,根据Ksp计算铁离子的浓度;
c.用氯酸钠在酸性条件下氧化Fe2+生成铁离子和氯离子;
d.根据图象判断生成黄铁矾钠的条件;
(4)经过加入Na2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等化合物的杂质,滤液中含有可溶性硫酸盐;
(5)含有Ni2+的溶液显绿色;
(6)向含有NiSO4溶液中加碳酸钠,得到NiCO3沉淀,过滤、洗涤,向沉淀中加硫酸溶解,得到NiSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得NiSO46H2O晶体。
(1)提高浸取率可采取将废渣粉碎、加热、搅拌以及增大硫酸浓度等措施;
(2)滴加Na2S溶液会生成CuS沉淀,离子反应式为:Cu2++S2-![]() CuS↓;
CuS↓;
(3)a.FeOOH中铁是+3价,a错误;
b.pH=4,c(OH-)=1×10-10mol·L-1,c(Fe3+)=![]() =2.64×10-9mol·L-1,b错误。
=2.64×10-9mol·L-1,b错误。
c项符合电荷守恒、得失电子守恒等守恒关系,也符合反应的酸碱性,c正确;
d.观察图象可知d正确;
故答案选cd;
(4)滤液Ⅲ之前已将Cu、Zn、Fe除去,所以滤液中主要含有NiSO4;
(5)由于Ni2+的水溶液为绿色,所以可通过观察滤液的颜色来判断碳酸镍是否完全沉淀;若沉淀完全,上层清液为无色;
(6)将NiCO3沉淀转化为NiSO4,要先通过过滤,并用蒸馏水洗净沉淀,再向沉淀中加6 mol/L的H2SO4溶液,直至恰好完全溶解,之后蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
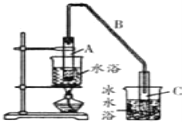
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水