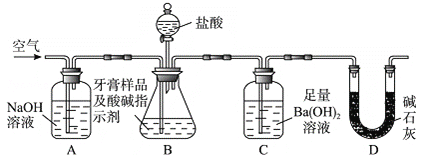
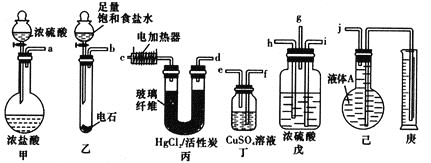
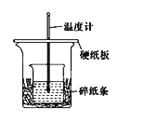
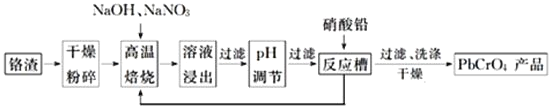
题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:
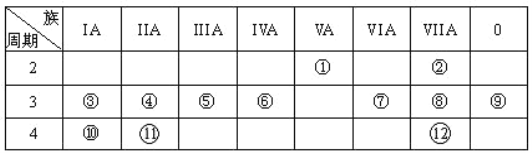
(1)写出①原子结构示意图_______________
(2)在这些元素中,金属性最强的元素是_______,(填元素符号)元素⑦与元素⑧相比,非金属性较强的是 _____________(填元素符号)
(3)⑤的最高价氧化物对应水化物与⑧的最高价氧化物对应水化物反应的离子方程式为:________________
(4)⑤的单质与③的最高价氧化物对应水化物反应的离子方程式为___________________________
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑦形成一种AB2型的化合物,请用电子式表示其形成过程:_____________________________ 。
【答案】![]() K Cl Al(OH)3+3H+=Al3++3H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
K Cl Al(OH)3+3H+=Al3++3H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ ![]()
【解析】
结合元素周期表的结构可知,①②③④⑤⑥⑦⑧⑨⑩分别为:N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,据此解答。
(1)①为N,其原子结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据同周期从左到右元素的金属性逐渐减弱、非金属性逐渐增强,同主族从上到下元素的金属性逐渐增强、元素的非金属性逐渐减弱,金属性最强的为⑩K,元素⑦与元素⑧相比,非金属性较强的是⑧(Cl),故答案为:K;Cl;
(3)⑤为Al,最高价氧化物对应水化物为Al(OH)3,⑧为Cl,其最高价氧化物对应水化物为HClO4,二者反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)⑤的单质即Al,③的最高价氧化物对应水化物即NaOH,Al和NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)原子最外层电子数是其次外层电子数的2倍,则该元素原子核外电子总数=2+4=6,该元素为C,与⑦形成AB2型化合物即CS2,用电子式表示CS2形成过程如下: ![]() →
→![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案