题目内容
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
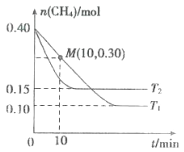
①根据如图判断该反应的△H___________0(填“>”“<”或“=”),理由是___________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=___________,反应的平衡常数K=______(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为___________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
【答案】CO2(g)+ 2NH3(g) = CO(NH2)2(s) + H2O(l) △H=-87.0kJ/mol < T1<T2,T2时CH4的平衡含量高,说明升高温度,化学平衡向逆反应方向移动,逆向吸热,正向放热 0.02mol·L-1·min-1 2.025 D 增大 2NH3 - 6e- + 6OH- = N2 + 6H2O c(Na+)>c(N3-)>c(OH-)>c(H+) 中 0.5a-b
【解析】
(1)已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol,②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ/mol,③H2O(l)=H2O(g) △H=+44.0 kJ/mol,根据盖斯定律,将①+②-③得:CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l) △H=(-159.5 kJ/mol)+(+116.5 kJ/mol)-(+44.0 kJ/mol)=-87.0kJ/mol,故答案为:CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l) △H=-87.0kJ/mol;
(2) ①根据图像,T2时先达到平衡,说明T2>T1,温度越高平衡时甲烷物质的量越大,说明平衡逆向进行,因此正反应为放热反应,△H<0,故答案为:<;T1<T2,T2时CH4的平衡含量高,说明升高温度,化学平衡向逆反应方向移动,逆向吸热,正向放热;
②温度为T1时,10min时,n(CH4)=0.3mol,根据方程式,反应的n(NO2)=2×(0.4mol-0.3mol)=0.2mol,NO2的平均反应速率v(NO2)=![]() = 0.02mol·L-1·min-1,
= 0.02mol·L-1·min-1,
根据图中信息可知,平衡时n(CH4)=0.10mol,故有:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
开始时浓度(mol/L) 0.4 1.0 0 0 0
改变的浓度(mol/L) 0.30 0.6 0.3 0.3 0.6
平衡时浓度(mol/L) 0.10 0.4 0.3 0.3 0.6
K=![]() ;
;
③A.改用高效催化剂,不能影响平衡的移动,不能提高NO2的转化率,选项A错误;
B.升高温度,反应速率加快,平衡逆向移动,NO2的转化率减小,选项B错误;
C.缩小容器的体积,物质的浓度增大,反应速率加快,平衡逆向移动,NO2的转化率减小,选项C错误;
D.增加CH4的浓度,反应速率加快,平衡正向移动,NO2的转化增大,选项D正确;
答案选D;
(3)利用原电池反应可实现NO2的无害化的总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液。工作时,正极上二氧化氮得到电子生成氮气,电极方程式为2NO2+8e-+4H2O=N2+8OH-,正极附近溶液的pH增大;负极上氨气失去电子生成氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:增大;2NH3-6e-+6OH-=N2+6H2O;
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3为强碱弱酸盐,水解呈碱性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(N3-)>c(OH-)>c(H+);混合后溶液中c(Ba2+)=0.5b mol/L,根据电荷守恒:2c(Ba2+)+c(H+)=c(N3-)+c(OH-),溶液中存在2c(Ba2+)= c(N3-),则c(H+)=c(OH-),溶液显中性;溶液中c(N3-)=b mol/L,由物料守恒可知溶液中c(HN3)=(0.5a-b)mol/L,故答案为:中;0.5a-b。