题目内容
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是 .
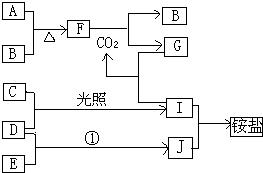
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去): ![]()
将Br2与Na2CO3反应的化学方程式补充完整:Br2+Na2CO3═NaBrO3++
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去): 
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 .
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为 .
④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClOg.
【答案】
(1)2Cl﹣+2H2O![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
(2)3;3;1;5NaBr;3CO2
(3)除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;Mg2++2H2O?Mg(OH)2+2H+;22.35
【解析】(1)电解氯化钠溶液在阴极生成氢氧化钠和氢气,阳极生成氯气,其电解反应的离子方程式是2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O
Cl2↑+H2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣;(2)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2 , Br元素部分由0价升高到+5价,另一部分从0价降低到﹣1价,则生成的NaBrO3与NaBr的物质的量之比为1:5,所以配平方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,所以答案是:3、3、1、5NaBr、3CO2;(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+ , 然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;所以答案是:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl﹣和H+ , 反应的离子方程式为:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;所以答案是:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;③镁离子水解生成氢氧化镁和氢离子,Mg2++2H2OMg(OH)2+2H+ , 水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;所以答案是:Mg2++2H2OMg(OH)2+2H+;④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,所以答案是:22.35.
Cl2↑+H2↑+2OH﹣;(2)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2 , Br元素部分由0价升高到+5价,另一部分从0价降低到﹣1价,则生成的NaBrO3与NaBr的物质的量之比为1:5,所以配平方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,所以答案是:3、3、1、5NaBr、3CO2;(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+ , 然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;所以答案是:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl﹣和H+ , 反应的离子方程式为:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;所以答案是:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;③镁离子水解生成氢氧化镁和氢离子,Mg2++2H2OMg(OH)2+2H+ , 水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;所以答案是:Mg2++2H2OMg(OH)2+2H+;④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,所以答案是:22.35.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用. 
(1)在上图构想的物质和能量循环中太阳能最终转化为能.
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g). 一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
2CH3OH(g)+3O2(g). 一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3min内该反应的平均反应速率为 .
②能说明该反应已达到平衡状态的是 .
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变
d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的极(填“正”或“负”),通入氧气的一极的电极反应式为 .