��Ŀ����
����Ŀ����ͼ��ʾ�Ĺ�����Ŀǰֱ������̫���ܵ��о��ȵ㣮���ǰ�ͨ���˹��⻯ѧ�ֶκϳ�ȼ�ϵĹ��̽����˹�������ã� 
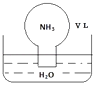
��1������ͼ��������ʺ�����ѭ����̫��������ת��Ϊ�ܣ�
��2���˹�������õ�;��֮һ�����ڴ������������£���CO2��H2Oת��ΪCH3OH���÷�Ӧ�Ļ�ѧ����ʽΪ��2CO2��g��+4H2O��g�� ![]() 2CH3OH��g��+3O2��g���� һ�������£���2L�ܱ������н���������Ӧ�����n��CH3OH����ʱ��ı仯���±���ʾ��
2CH3OH��g��+3O2��g���� һ�������£���2L�ܱ������н���������Ӧ�����n��CH3OH����ʱ��ı仯���±���ʾ��
ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n��CH3OH��/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
����CH3OH��ʾ0��3min�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ ��
����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a��v����H2O��=2v����CO2��
b��n��CH3OH����n��O2��=2��3
c���������ܶȱ��ֲ���
d��������ѹǿ���ֲ���
��3�����˹�������õõ��ļ״���������ϡ��������ȼ�ϵ�أ���״�Ӧͨ���ȼ�ϵ�ص������������������ͨ��������һ���ĵ缫��ӦʽΪ ��
���𰸡�
��1����
��2��0.015mol?L��1?min��1�� ad
��3������ O2+4H++4e��=2H2O
���������⣺��1���ɾ�ͼ��֪��̫��������ת��Ϊ��ѧ�ܣ���λ�ѧ��ת��Ϊ���ܣ����Դ��ǣ��ȣ���2����0��3min�ڼ״������ʵ����仯0.090mol����v= ![]() =0.015molL��1min��1��
=0.015molL��1min��1��
���Դ��ǣ�0.015molL��1min��1��
��a��v����H2O��=2v����CO2������˵�����淴Ӧ������ȣ��ﵽƽ��״̬����a��ȷ��
b�������Ƿ�ﵽƽ��״̬������������ʵ���֮�ȶ����ڻ�ѧ������֮�ȣ���n��CH3OH����n��O2��=2��3����b����
c�������������Լ��������䣬���������ܶȱ��ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬����c����
d����Ӧǰ�������������ȣ�������ѹǿ���ֲ��䣬��˵���ﵽƽ��״̬����d��ȷ��
���Դ��ǣ�ad����3����Ӧ�м״���������ӦΪ��صĸ���������������ԭ��Ӧ����������ԭ����ˮ���缫����ʽΪO2+4H++4e��=2H2O��
���Դ��ǣ�����O2+4H++4e��=2H2O��
�����㾫�������շ�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ж��ǽ����ĸ�������Ҫ֪���ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

����Ŀ�������Ԫ�����ڱ���һ���֣��û�ѧ����ش�
�� | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
�� | ] | �� | �� | ||||
�� | �� | �� | �� | �� | |||
�� | �� |
��1���ڵ�Ԫ�ط���Ϊ ��
��2���Ƚ�Ԫ�آۺ͢ߵ�ԭ�Ӱ뾶��С�����ߣ��������������
��3�����Ԫ�آݵ����ӽṹʾ��ͼ ��
��4��Ԫ�آٵ��⻯��ĵ���ʽΪ �� �����⻯��ͨ��ܺ͢��γɵĻ������ˮ��Һ�У�������Ӧ�����ӷ���ʽΪ ��
����Ŀ����ˮ��һ����Ļ�ѧ��Դ���⣬���ú�ˮ���Ի�úܶ����Ʒ��
��1����ˮ���Ƶõ��Ȼ��ƿ����������ռ��������Ӧ�����ӷ���ʽ�� ��
��2���������κ����±��ȡ��Ĺ����������£����ֲ�������������ȥ���� ![]()
��Br2��Na2CO3��Ӧ�Ļ�ѧ����ʽ����������Br2+Na2CO3�TNaBrO3++
��3����±������ȴ������±�����Ҫ�ɷ���MgCl2 �� �����Fe2+��Fe3+��Mn2+�����ӣ���±��Ϊԭ���Ƶ�þ�Ĺ����������£����ֲ�������������ȥ���� 
�����������������pH
���� | ��ʼ���� | ������ȫ |
Fe��OH��3 | 2.7 | 3.7 |
Fe��OH��2 | 7.6 | 9.6 |
Mn��OH��2 | 8.3 | 9.8 |
Mg��OH��2 | 9.6 | 11.1 |
�ٲ�����������pH=9.8����Ŀ���� ��
����NaClO ����Fe2+�õ�Fe��OH��3���������ӷ�Ӧ����ʽ�� ��
�۲��������HCl�������м��Ƚ��У���ԭ���漰�����ӷ���ʽΪ ��
��NaClO���ܳ�ȥ��±�е�CO��NH2��2 �� �����������ʺ��ܲ������ѭ�������ʣ���ȥ0.1mol CO��NH2��2ʱ����NaClOg��