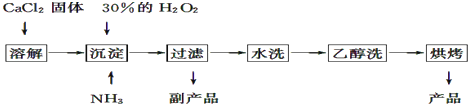
题目内容
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①式化工生产中的一种重要固氮反应. 请回答下列问题: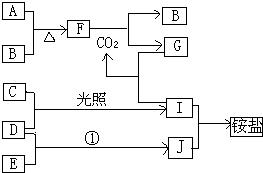
(1)、 A、B、C、D、E、F、G、I、J各为什么物质?
(2)写出下列物质间反应的化学方程式:A和B,F和CO2 , D和E,I和J.
(3)写出化合物G与I反应的离子方程式.
【答案】
(1)Na;O2;Cl2;H2;N2;Na2O2;a2CO3;HCl;NH3
(2)2Na2O2+2CO2=2Na2CO3+O2;N2+3H2![]() 2NH3;HCl+NH3=NH4Cl
2NH3;HCl+NH3=NH4Cl
(3)CO32﹣+2H+=CO2↑+H2O
【解析】解:反应①是化工生产中的一种重要固氮反应,证明是氮气和氢气合成氨的反应,判断J为NH3,化合物I和J通常状况下呈气态,CD是非金属单质,依据反应条件是光照,推断为氢气和氯气生成氯化氢的反应,判断D为H2,E为N2,C为Cl2,I为HCl,J为NH3;化合物G的焰色反应为黄色说明含钠元素,G与HCl反应生成CO2,说明G为Na2CO3,气体单质B和A反应生成的F可以与二氧化碳反应生成碳酸钠和气体B单质,说明F中 含有钠元素,证明A为金属钠,推断B为O2,F为Na2O2;(1)根据上面的分析可知,A为Na,B为O2,C为Cl2,D为H2,E为N2,F为Na2O2,G为Na2CO3,I为HCl,J为NH3,
所以答案是:Na;O2;Cl2;H2;N2;Na2O2;a2CO3;HCl;NH3;(2)A和B的化学方程式为,F和CO2的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,D和E的化学方程式为N2+3H2 ![]() 2NH3,I和J的化学方程式为HCl+NH3=NH4Cl,
2NH3,I和J的化学方程式为HCl+NH3=NH4Cl,
所以答案是:2Na2O2+2CO2=2Na2CO3+O2;N2+3H2 ![]() 2NH3;HCl+NH3=NH4Cl;(3)化合物G与I反应的离子方程式为CO32﹣+2H+=CO2↑+H2O,所以答案是:CO32﹣+2H+=CO2↑+H2O.
2NH3;HCl+NH3=NH4Cl;(3)化合物G与I反应的离子方程式为CO32﹣+2H+=CO2↑+H2O,所以答案是:CO32﹣+2H+=CO2↑+H2O.

 阅读快车系列答案
阅读快车系列答案【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是 .
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去): ![]()
将Br2与Na2CO3反应的化学方程式补充完整:Br2+Na2CO3═NaBrO3++
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去): 
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 .
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为 .
④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClOg.