题目内容
某温度下的密闭容器中,发生如下可逆反应:2E(g)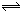 F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
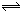 F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )| A.升高温度时,正反应速率加快,逆反应速率减慢 |
| B.若x=1,容器体积保持不变,新平衡下E的体积分数为50% |
| C.若x="2,容器体积保持不变,新平衡下F的平衡浓度为0.5a" mol/L |
| D.若x="2,容器压强保持不变,新平衡下E的浓度为a" mol/L |
BD
升高温度,反应速率一定是增大的,A不正确。若x="1,则反应前后体积不变,所以在这两种情况下平衡是等效的,所以含量是相同的,B正确。若x=2,则反应是体积增大的可逆反应。若E的起始浓度改为2" a mol/L,相当于增大压强,平衡向逆反应方向移动,所以新平衡下F的平衡浓度小于0.5a mol/L,C不正确。若压强不变,则属于等效平衡,因此选项D正确。答案选BD。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2NH3(正反应为放热反应)达到平衡后,下列选项中三种方法都能使平衡向正反应方向移动的是( )
2NH3(正反应为放热反应)达到平衡后,下列选项中三种方法都能使平衡向正反应方向移动的是( ) pC(g),达到平衡时,测得c(C)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(C)为0.3 mol·L-1。则下列判断正确的是( )
pC(g),达到平衡时,测得c(C)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(C)为0.3 mol·L-1。则下列判断正确的是( )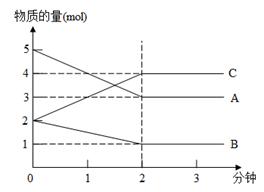
 2SO3(g) ?H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ?H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是 2SO3 ,这是一个正反应放热的可逆反应。下列有关说法中错误的是()
2SO3 ,这是一个正反应放热的可逆反应。下列有关说法中错误的是() PCl3(g)+Cl2(g);△H1>0 K1=10
PCl3(g)+Cl2(g);△H1>0 K1=10