题目内容
在恒温恒容条件下,向容积为2L的密闭容器中充入2.0molSO2和2.0molO2。已知:2SO2(g)+O2(g) 2SO3(g) ?H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ?H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
 2SO3(g) ?H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ?H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是| A.在1min时:c(SO3)+c(SO2)="1.0" mol·L-1 |
| B.在2min内:v(SO2)="0.25" mol·L-1·min-1 |
| C.若再充入2molSO3,达到平衡时SO3的质量分数减小 |
| D.反应条件相同,若起始时向反应容器充入2molSO3,达到平衡时反应吸热0.75 akJ |
A
根据硫原子守恒可知A是正确的。根据方程式可知,当反应放热0.25akJ时,消耗的二氧化硫是0.5mol,生成三氧化硫也是0.5mol,剩余二氧化硫是1.5mol,其浓度是
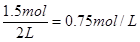 ,B不正确。若平衡时再充入2molSO3,则相当于增大压强,平衡向正反应方向移动,所以达到平衡时SO3的质量分数增大,C不正确。2molSO3相当于2.0molSO2和1.0molO2,因此和原状态比较二氧化硫的转化率要降低,平衡时三氧化硫的物质的量要小于0.5mol,所以达到平衡时反应吸热的能量要大于0.75 akJ,D不正确。答案选A。
,B不正确。若平衡时再充入2molSO3,则相当于增大压强,平衡向正反应方向移动,所以达到平衡时SO3的质量分数增大,C不正确。2molSO3相当于2.0molSO2和1.0molO2,因此和原状态比较二氧化硫的转化率要降低,平衡时三氧化硫的物质的量要小于0.5mol,所以达到平衡时反应吸热的能量要大于0.75 akJ,D不正确。答案选A。
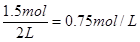 ,B不正确。若平衡时再充入2molSO3,则相当于增大压强,平衡向正反应方向移动,所以达到平衡时SO3的质量分数增大,C不正确。2molSO3相当于2.0molSO2和1.0molO2,因此和原状态比较二氧化硫的转化率要降低,平衡时三氧化硫的物质的量要小于0.5mol,所以达到平衡时反应吸热的能量要大于0.75 akJ,D不正确。答案选A。
,B不正确。若平衡时再充入2molSO3,则相当于增大压强,平衡向正反应方向移动,所以达到平衡时SO3的质量分数增大,C不正确。2molSO3相当于2.0molSO2和1.0molO2,因此和原状态比较二氧化硫的转化率要降低,平衡时三氧化硫的物质的量要小于0.5mol,所以达到平衡时反应吸热的能量要大于0.75 akJ,D不正确。答案选A。
练习册系列答案
相关题目
 2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。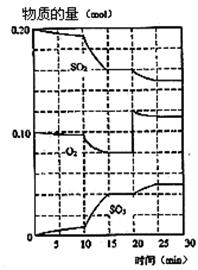
 WI2(g)ΔH<0
WI2(g)ΔH<0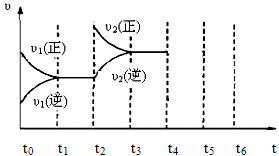
 F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( ) 2NH3(g)不能作为达到平衡状态的依据的是
2NH3(g)不能作为达到平衡状态的依据的是 N2O4(g);△H<0。则以下说法不正确的是 ( )
N2O4(g);△H<0。则以下说法不正确的是 ( )
 nC(g)+4D(g),起始时,将amol的A与bmol的B充入固定容积的密闭容器中,在一定条件下达平衡,测得A、B的转化率相等。
nC(g)+4D(g),起始时,将amol的A与bmol的B充入固定容积的密闭容器中,在一定条件下达平衡,测得A、B的转化率相等。 (A)=50%,测得平衡混合气体总物质的量为17mol。
(A)=50%,测得平衡混合气体总物质的量为17mol。