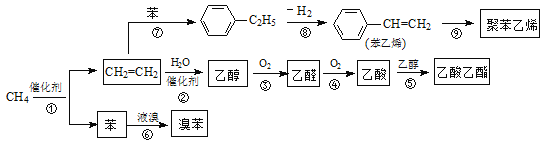
题目内容
【题目】以乙烯为原料合成化合物C的流程如图所示:
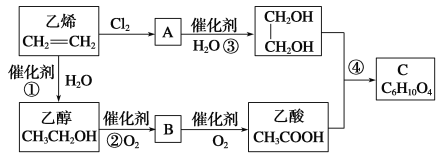
(1)写出A的结构简式:________________
(2)乙酸分子中的官能团名称是_________,写出1种可鉴别乙醇和乙酸的化学试剂: _____________________。(2分)
(3)写出反应①、②、④的化学方程式并指出反应类型
①_____________________________________________;_____________;
②_____________________________________________;_____________;
④_____________________________________________;_____________。
【答案】(1)ClCH2CH2Cl(2分)
(2)羧基(1分) 紫色石蕊试液 碳酸钠溶液 (或其它合理答案) (2分)
(3)①CH2=CH2 + H2O ![]() CH3CH2OH(2分),加成反应(1分);
CH3CH2OH(2分),加成反应(1分);
②2CH3CH2OH+O2![]() 2CH3CHO+2H2O(2分),氧化反应(1分);
2CH3CHO+2H2O(2分),氧化反应(1分);
④2CH3COOH+HOCH2—CH2OH![]() CH3COOCH2—CH2OOCCH3+2H2O(2分),酯化(取代)反应(1分)
CH3COOCH2—CH2OOCCH3+2H2O(2分),酯化(取代)反应(1分)
【解析】
试题分析:乙烯含有碳碳双键与氯气发生加成反应生成A,A的结构简式为ClCH2CH2Cl,A水解生成乙二醇。乙烯和水发生加成反应生成乙醇,乙醇催化氧化生成乙醛,即B是乙醛。乙醛再氧化生成乙酸,乙酸与乙二醇发生酯化反应生成C,结构简式为CH3COOCH2-CH2OOCCH3。
(1)根据以上分析可知A的结构简式为ClCH2CH2Cl。
(2)乙酸的官能团是羧基,乙酸显酸性,乙醇中性,则鉴别乙酸和乙醇的化学试剂可以是紫色石蕊试液或碳酸钠溶液。
(3)根据以上分析可知写出反应①、②和④的化学方程式分别是CH2=CH2 + H2O ![]() CH3CH2OH 、2CH3CH2OH+O2
CH3CH2OH 、2CH3CH2OH+O2![]() 2CH3CHO+2H2O、2CH3COOH+HOCH2-CH2OH
2CH3CHO+2H2O、2CH3COOH+HOCH2-CH2OH![]() CH3COOCH2-CH2OOCCH3+2H2O
CH3COOCH2-CH2OOCCH3+2H2O

【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
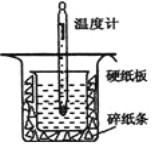
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________,除此之外,装置中的一个明显错误是 。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量________ ___(填“相等”、“不相等”),若实验操作均正确,则所求中和热________ ___(填“相等”“不相等”)。
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
|
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______ ____ ( 取小数点后一位)。