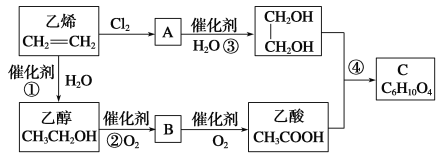
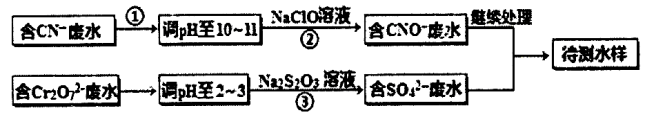题目内容
【题目】铝土矿是工业上制取铝的基本原料.为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,化学兴趣小组设计探究实验,操作过程如图所示:
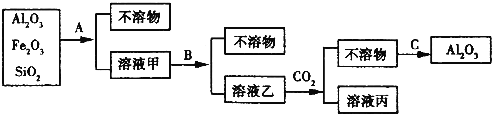
(1)操作过程中的试剂或方法:A加入的试剂______,B加入的试剂______,C采用的方法______。
(2)在溶液乙中通入过量CO2后发生反应的离子方程式为_______________。
(3)如果A、B互换,则通C02应改加______。
(4)如果A、B互换,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______(写化学式)。
【答案】(1)盐酸;氢氧化钠;加热 (2)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
(3)氨水 (4)Al2O3、NaCl
【解析】
试题分析:氧化铝是两性氧化物,既溶液强酸又溶于强碱。Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸。由工艺流程可知,溶液乙中通入二氧化碳得到不溶物,不溶物可以得到氧化铝,故溶液乙中含有偏铝酸根,则A应为盐酸,过滤得到不溶为SiO2,溶液甲中含有铝离子、铁离子,再加入氢氧化钠溶液,除去铁离子,不溶物为氢氧化铁,将铝离子转化为偏铝酸根,过滤偏铝酸根进入溶液乙中,在溶液中与二氧化碳反应生成Al(OH)3,加热生成Al2O3,
(1)由上述分析可知,A为盐酸、过滤,B为氢氧化钠、过滤,C为加热;
(2)偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(3)若将A、B互换,溶液甲中含有偏铝酸根离子、硅酸根离子,再加入盐酸,溶液乙中主要含有铝离子、氯离子、钠离子,应加入氨水将铝离子转化氢氧化铝沉淀;
(4)若将A、B互换,溶液乙中主要含有铝离子、氯离子、钠离子,加热溶液乙,HCl挥发、铝离子水解,得到Al(OH)3及NaCl,灼烧Al(OH)3分解生成Al2O3,故所得固体产物的主要成分是Al2O3、NaCl。

 阅读快车系列答案
阅读快车系列答案【题目】为了探究化学反应中的能量变化,某同学设计了如下两个实验。

(1)图Ⅰ中发生反应的化学方程式为 ,实验中温度计指示的温度变化及其原因是 。
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释。
实验现象 | 解释原因 |
Cu片上产生了大量气泡 | |
温度计指示的温度无明显变化 |
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为 。
【题目】元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素。请回答下列问题。
a | |||||||||||||||||
c | b | n | |||||||||||||||
d | e | o | f | ||||||||||||||
m | r | g | |||||||||||||||
(1)g元素的原子序数为 ;上述所给11种元素中非金属元素共有 种。
(2)m元素在元素周期表中的位置 ;e、n二元素形成的稳定化合物的化学式为 。
(3)o元素离子的电子式为 ;化合物ba3的结构式为 。
(4)用电子式表示化合物d2n的形成过程 ;
(5)d的最高价氧化物的水化物与e的最高价氧化物反应的离子方程式 。
(6)单质r与b的最高价氧化物的水化物的稀溶液反应的离子方程式 。
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照表中所示方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是 。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 。
(3)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(4)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析图像能够得出的实验结论是 。