题目内容
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
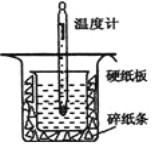
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________,除此之外,装置中的一个明显错误是 。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量________ ___(填“相等”、“不相等”),若实验操作均正确,则所求中和热________ ___(填“相等”“不相等”)。
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
|
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______ ____ ( 取小数点后一位)。
【答案】
(1)环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)
(2)不相等;相等
(3)①3.4 ②-56.8kJ/mol
【解析】
试题分析:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平;故答案为:环形玻璃搅拌器;大烧杯杯口与小烧杯杯口没有相平;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25molL-1H2SO4溶液跟50mL0.55molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;故答案为:不相等;相等;
(3)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据明显有误,所以删掉,温度差平均值为![]() =3.4℃;故答案为:3.4;
=3.4℃;故答案为:3.4;
②0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.4℃来计算,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-![]() =-56.8 kJ/mol,故答案为:-56.8 kJ/mol。
=-56.8 kJ/mol,故答案为:-56.8 kJ/mol。

【题目】元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素。请回答下列问题。
a | |||||||||||||||||
c | b | n | |||||||||||||||
d | e | o | f | ||||||||||||||
m | r | g | |||||||||||||||
(1)g元素的原子序数为 ;上述所给11种元素中非金属元素共有 种。
(2)m元素在元素周期表中的位置 ;e、n二元素形成的稳定化合物的化学式为 。
(3)o元素离子的电子式为 ;化合物ba3的结构式为 。
(4)用电子式表示化合物d2n的形成过程 ;
(5)d的最高价氧化物的水化物与e的最高价氧化物反应的离子方程式 。
(6)单质r与b的最高价氧化物的水化物的稀溶液反应的离子方程式 。