题目内容
实验室可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“双线桥”标出电子转移的方向和数目;(2分)
②该反应中被氧化和未被氧化的HCl的物质的量之比是 _______。(1分)
① ②5:3
②5:3
解析试题分析:根据方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O可知,高锰酸钾中Mn元素的化合价从+7价降低到+2价,得到5个电子,高锰酸钾是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比1:5,据此可以用双线桥标出电子转移的方向和数目(见答案);根据方程式可知2mol高锰酸钾与16mol氯化氢反应,其中被氧化的氯化氢是5mol×2=10mol,则未被氧化的氯化氢是16mol-10mol=6mol,因此该反应中被氧化和未被氧化的HCl的物质的量之比是10:6=5:3。
考点:考查氧化还原反应的表示以及有关计算与判断

练习册系列答案
相关题目
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O="_______" Fe(OH)3(胶体)+_______O2↑+_______OH-。
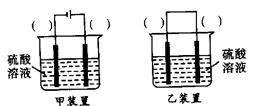
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。

(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为________ 。
 CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
 2Cu+SO2
2Cu+SO2