题目内容
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。

Ⅰ.测定过氧化氢的含量
(1)取10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式: _____________________________________________________
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为:_________________________。
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是__________,写出产生气体这一现象的反应的化学方程式__________________________。
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是___________________________。
I.(1)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑ (2分)
(2)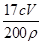 (2分)(其他正确也给分)
(2分)(其他正确也给分)
II.(1)①Cu+H2O2+2H+=Cu2++2H2O (2分)
②催化剂 (2分) 2H2O2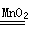 2H2O+O2↑ (2分)
2H2O+O2↑ (2分)
(2)ClO-+H2O2=Cl-+O2↑+H2O (2分)
解析试题分析:Ⅰ.测定过氧化氢的含量(1)滴定过程中,高锰酸钾溶液在稀硫酸存在的条件下,将H2O2氧化为O2,而本身被还原为Mn2+,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;(2)设25mL双氧水溶液中含有双氧水的质量是x,根据离子方程式得关系式:
5H2O2——2KMnO4
170g 2mol
x 10-3cVmol
解得x="0.085" cVg
则250mL双氧水溶液中双氧水的质量是0.85 cVg,双氧水溶液的质量为10ρ g,所以其质量分数
="0.85" cV/10ρ ×100%=17cv/200ρ;
Ⅱ.探究过氧化氢的性质(1)H2O2与铜的有关探究实验:①根据题意知,将铜丝置于用硫酸酸化的H2O2溶液中,铜被氧化为铜离子,H2O2被还原为水,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;②根据题意知,将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是催化剂,反应的化学方程式
2H2O2= 2H2O+O2↑;(2)根据题给信息可写出离子方程式为:ClO-+H2O2=Cl-+O2↑+H2O。
考点:以过氧化氢含量的测定及性质的探究为载体,考查离子方程式的书写及滴定过程的计算。

Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为________________________;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为______________________。
(2)请以FeSO4溶液、KI溶液、氯水、2% KSCN为试剂证明I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 | 现象:溶液变成黄色。 结论: 。 |
| 步骤2:__________________________ __________________________________ | 现象: ; 结论: |
(3)利用 中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, 。
(4)向含2mol FeI2溶液中通入2.5mol Cl2时,请写出总的离子方程式: 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)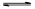 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 mo1/L 。
 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。