题目内容
下列各组离子在给定条件下能大量共存的是( )
| A、能使pH试纸呈红色的溶液:Na+、NH4+、Cl-、NO3- |
| B、滴入KSCN溶液显血红色的溶液:K+、Na+、CO32-、I- |
| C、能与铝反应产生H2的溶液:K+、Fe2+、Cl-、NO3- |
| D、常温下由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:A.能使pH试纸呈红色的溶液为酸性溶液,Na+、NH4+、Cl-、NO3-离子之间不发生反应,也不与酸溶液反应;
B.滴入KSCN溶液显血红色的溶液中存在Fe3+离子,铁离子能够与碘离子、碳酸根离子发生反应;
C.能与铝反应产生H2的溶液为酸溶液或者强碱溶液,亚铁离子能够与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.常温下由水电离出的c(H+)=1×10-13mol/L的溶液为酸性或者碱性溶液,碳酸氢根离子既能够与酸反应,也能够与碱溶液反应.
B.滴入KSCN溶液显血红色的溶液中存在Fe3+离子,铁离子能够与碘离子、碳酸根离子发生反应;
C.能与铝反应产生H2的溶液为酸溶液或者强碱溶液,亚铁离子能够与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.常温下由水电离出的c(H+)=1×10-13mol/L的溶液为酸性或者碱性溶液,碳酸氢根离子既能够与酸反应,也能够与碱溶液反应.
解答:
解:A.能使pH试纸呈红色的溶液中存在大量氢离子,Na+、NH4+、Cl-、NO3-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.滴入KSCN溶液显血红色的溶液Fe3+离子,CO32-、I-离子能够与Fe3+发生反应,在溶液中不能大量共存,故B错误;
C.能与铝反应产生H2的溶液中存在大量氢离子或者氢氧根离子,Fe2+能够与氢氧根离子反应,NO3-离子在酸性条件下能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.常温下由水电离出的c(H+)=1×10-13mol/L的溶液中存在大量氢离子或者氢氧根离子:HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选A.
B.滴入KSCN溶液显血红色的溶液Fe3+离子,CO32-、I-离子能够与Fe3+发生反应,在溶液中不能大量共存,故B错误;
C.能与铝反应产生H2的溶液中存在大量氢离子或者氢氧根离子,Fe2+能够与氢氧根离子反应,NO3-离子在酸性条件下能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.常温下由水电离出的c(H+)=1×10-13mol/L的溶液中存在大量氢离子或者氢氧根离子:HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选A.
点评:本题考查离子共存的正误判断,为高考中的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列氧化还原反应电子得失情况表示正确的是( )
A、 |
B、 |
C、 |
D、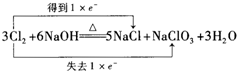 |
某原电池的结构如图所示,下列有关该原电池的说法正确的是( )
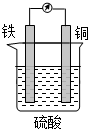

| A、该电池工作时电能转变为化学能 |
| B、铜片的质量增加 |
| C、H+向铁片移动 |
| D、铁片上发生的反应是Fe-2e-═Fe2+ |
 甲烷分子中4个氢原子被苯基取代,如图所示,对该分子描述正确的是( )
甲烷分子中4个氢原子被苯基取代,如图所示,对该分子描述正确的是( )| A、该物质属于芳香烃,是苯的同系物 |
| B、所有的碳原子可能在同一平面 |
| C、此物质属于高分子化合物 |
| D、此分子的一氯取代物有3种 |
NA表示阿伏加德罗常数,下列说法不正确的是( )
| A、常温常压下,16g O2和16g O3含有的原子数均为NA |
| B、9g重水所含有的电子数为5NA |
| C、100mL 0.1mol/L的Na2SO4溶液中含SO42-的个数为0.01NA |
| D、常温常压下,1mol H2所含的质子数为NA |
下列不属于氧化还原反应的是( )
| A、2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 |
| B、工业制漂白粉 |
| C、氯碱工业制氯气 |
| D、Na2O2+2HCl═2NaCl+H2O2 |
下列说法不正确的是( )
| A、漂白粉长时间露置空气中会变质失效 |
| B、澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C、高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D、金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
