题目内容
【题目】25℃ 时,用0.10mol·L-1的盐酸分别滴定体积相同且浓度均为0.10mol·L-1的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。
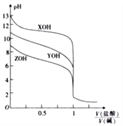
下列说法正确的是( )
A. YOH是强碱 B. 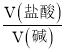 =0.5时,c(Z+)>c(Y+)>c(X+)
=0.5时,c(Z+)>c(Y+)>c(X+)
C. X++H2O![]() XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
【答案】D
【解析】A、根据图像,滴定YOH曲线的起点,0.1mol·L-1的YOH溶液的pH<13,说明YOH为弱碱,故A错误;B、根据滴定的曲线的起点,XOH为强碱,ZOH为弱碱,碱性强弱为XOH>YOH>ZOH,当V(盐酸):V(碱)=0.5时,三种溶液中溶质分别是XCl和XOH、YCl和YOH、ZCl和ZOH,且它们的物质的量相同,碱性越强,电离度越大,因此离子浓度为c(X+)>c(Y+)>c(Z+),故B错误;C、XOH为强碱,X+不发生水解,故C错误;D、强酸滴定强碱,可以用酚酞作指示剂,也可以用甲基橙作指示剂,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】研究铝元素、硫元素及其化合物的性质具有重要意义
(1)①NH4A1(SO4)2可作净水剂,用必要的化学用语及文字说明其理由是_________。
②相同条件下,0.1mol NH4A1(SO4)2溶液中的c(NH4+)______(填“大于”“小于”或“等于”)0.1mol·L-1NH4HSO4溶液中的c(NH4+)。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=_____mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=______。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为_____。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。