题目内容
【题目】制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得.用以上两种方法都可制得的氯化物是( )
A.AlCl3
B.FeCl3
C.FeCl2
D.CuCl2
【答案】A
【解析】解:A、金属铝和氯气反应生成氯化铝,和盐酸反应生成氯化铝和氢气,故A正确;B、金属铁和氯气反应生成氯化铁,和盐酸反应生成氯化亚铁和氢气,故B错误;
C、金属铁和氯气反应生成氯化铁,和盐酸反应生成氯化亚铁和氢气,故C错误;
D、金属铜和氯气反应生成氯化铜,但是金属铜和盐酸不反应,故D错误.
故选A.
金属和氯气反应时,氯气将金属氧化到最高价态,变价金属和盐酸反应时,生成低价态的盐和氢气.

 第1卷单元月考期中期末系列答案
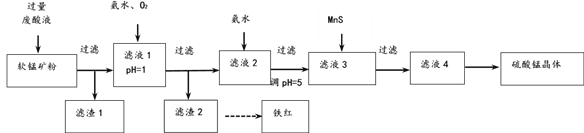
第1卷单元月考期中期末系列答案【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下
Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。