题目内容
5.下列关于元素周期律的说法正确的是( )| A. | 酸性强弱:H3PO4<H2SO4 | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 非金属性:N<Si |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>P,所以酸性H3PO4<H2SO4,故A正确;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>S,所以氢化物的稳定性HF>H2S,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Ca>Mg,所以碱性Ca(OH)2>Mg(OH)2,故C错误;
D.同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,所以非金属性N>C>Si,则非金属性N>Si,故D错误.
故选AB.
点评 本题考查同一主族、同一周期元素性质递变规律,为高考高频点,明确元素金属性强弱、非金属性强弱的判断方法,熟练掌握元素周期律,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
15.用如图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是( )
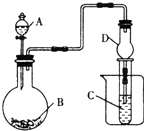

| A. | 若A为浓盐酸,B为KMnO4(KMnO4在常温下能与浓盐酸反应),C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为硫酸,B为大理石,C中盛澄清石灰水,则C中溶液先出现浑浊后变澄清 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解 | |
| D. | 上述实验中仪器D可以用长玻璃导管代替 |
16.下列各组物质中,硫元素的化合价均为+4的是( )
| A. | Na2SO3 | B. | H2S2O7 | C. | Na2SO4 | D. | Na2S2O3 |
13.将Cl2通入自来水中杀菌消毒,主要是利用了Cl2和H2O生成的HClO的( )
| A. | 强氧化性 | B. | 酸性 | C. | 还原性 | D. | 稳定性 |
20.下列关于元素周期律的说法正确的是( )
| A. | 非金属性:N<Si | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 酸性强弱:H3PO4<H2SO4 |
15.NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A. | 常温常压下,质量为32gO2含有的原子数为2NA | |
| B. | 2L0.1mol/LNaCl溶液中含有NaCl分子数为0.2NA | |
| C. | 78gNa2O2与足量CO2完全反应吗,转移的电子数为2NA | |
| D. | 在25℃,101Pa条件下,11.2L氯气所含的原子数为NA |
16.下列说法正确的是( )
| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
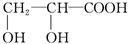 乙:
乙: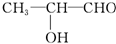
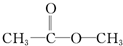 丁:
丁: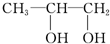
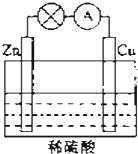 电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.