题目内容
11.图表示汽车尾气净化处理过程,有关叙述正确的是( )
| A. | 上述过程中,NOX只被CO还原 | |
| B. | 安装该净化器的汽车使用含铅汽油不会造成污染 | |
| C. | 产生22.4L氮气(标准状况)时,转移4xmole- | |
| D. | Pt-Rh催化剂可提高尾气平衡转化率 |
分析 A.根据元素化合价变化判断;
B.根据安装这种净化器,不能减少铅的排放;
C.根据生成1个氮气转移4x个电子;
D.根据催化剂只能改变反应速率,不能改变平衡移动;
解答 解:A.该反应过程中,CO和CxHy均失电子而作还原剂,NOX被CO和CxHy还原,故A错误;
B.安装这种净化器,不能减少铅的排放,所以仍然造成铅污染,故B错误;
C.产生22.4L氮气即1mol(标准状况)时,转移4xmol e-,故C正确;
D.催化剂只能改变反应速率,不能改变平衡移动,所以不能提高尾气平衡转化率,故D错误;
故选:C.
点评 本题考查氧化还原反应、外界条件对速率和平衡的影响,明确元素化合价是解本题关键,难度不大.

练习册系列答案
相关题目
20.下列关于元素周期律的说法正确的是( )
| A. | 非金属性:N<Si | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 酸性强弱:H3PO4<H2SO4 |
19.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI.L-l浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 28gN2与28g C18O中含有的质子数均为14 |
16.下列说法正确的是( )
| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
3.下列实验装置设计合理,且能达到相应实验目的是:( )
| 选项 | 实验装置 | 实验目的 |
| A | 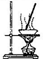 | 加热硫酸铜晶体获得无水硫酸铜 |
| B | 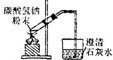 | 加热碳酸氢钠,证明它能分解释放出二氧化碳气体 |
| C |  | 实验室制取氯气 |
| D | 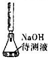 | 用中和滴定的方法测定某氢氧化钠待测液的浓度 |
| A. | A | B. | B | C. | C | D. | D |
20.下列选项中,离子方程式书写正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| B. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| C. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H20═2Al(OH)3↓+3CO2↑ | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- |
1.化学与科学、技术、社会、环境密切相关,下列叙述正确的是( )
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |


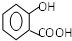 .
. .
. 已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:
已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答: