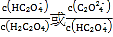题目内容
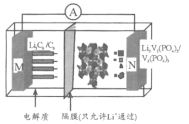
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知: ① 硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。
② Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
③ 常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4mol/L的浓硫酸配制500mL2mol/L的硫酸时除用量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有_________________________。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式__________。
(3)过滤II操作得到的滤渣主要为______(填化学式)。
(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_________________。
(5)上述流程中,每还原1molCrO42-时,需要消耗SO2 _______ mol。
【答案】500mL容量瓶、胶头滴管 2Cr3++3H2O2+H2O=Cr2O72-+8H+ Fe(OH)3、 Al(OH)3 Mg2+、 Ca2+ 1.5
【解析】
含铬污泥加稀硫酸和水并将溶液的PH调节为1,根据信息①硫酸浸取液的金属离子主要是Cr3+,其次是Fe2+、 Al3+、 Ca2+和Mg2+,然后过滤,向滤液中加入双氧水,Fe2+被氧化为Fe3+,Cr3+被氧化生成Cr2O72-,向溶液中加入NaOH溶液并调节溶液的pH=8,根据表中数据,溶液中Fe3+、Al3+生成沉淀,且溶液中Cr2O72-转化为CrO42-,然后过滤,向滤液中加入钠离子交换树脂,除去Ca2+和Mg2+,最后向溶液中通入二氧硫发生应2 CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-。
(1)配制一定物质的量浓度的溶液所需玻璃仪器:量筒、烧杯、玻璃棒、容量瓶和胶头滴管,设浓硫酸的体积为xmL,根据![]() =0.50L×2mol·L-1,可知x=5.3mL,实验室用18.4 mol/L的浓硫酸配制500mL2mol/L的硫酸时,除要用量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管。
=0.50L×2mol·L-1,可知x=5.3mL,实验室用18.4 mol/L的浓硫酸配制500mL2mol/L的硫酸时,除要用量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管。
(2)H2O2具有强氧化性,Cr3+具有还原性,H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+。
(3)pH=8,根据表中数据,溶液中Fe3+、Al3+生成沉淀,过滤II操作得到的滤渣主要为 Fe(OH)3、Al(OH)3。
(4)钠离子交换树脂的反应原理为: Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有Mg2+、Ca2+ 。
(5)上述流程中,最后向溶液中通入二氧硫发生应2 CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-,每还原1molCrO42-时,需要消耗SO2 的物质的量为![]() mol=1.5 mol。
mol=1.5 mol。

 阅读快车系列答案
阅读快车系列答案【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
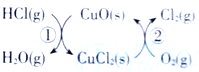
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |