题目内容
【题目】我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3。下列有关说法正确的是
6C+Li3V2(PO4)3。下列有关说法正确的是
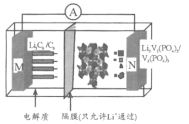
A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
【答案】B
【解析】
原电池的正极上发生得电子的还原反应,在电解池的阳极上发生失电子的氧化反应;锂离子电池的总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3,则该电池放电时正极上发生得电子的还原反应,即电极反应式为V2(PO4)3+3Li++3e-=Li3V2(PO4)3,负极为Li3C6材料,电极反应Li3C6-3e-→3Li++6C。
6C+Li3V2(PO4)3,则该电池放电时正极上发生得电子的还原反应,即电极反应式为V2(PO4)3+3Li++3e-=Li3V2(PO4)3,负极为Li3C6材料,电极反应Li3C6-3e-→3Li++6C。
A. 该电池比能量高,原电池的正极上发生得电子的还原反应,在电解池的阳极上发生失电子的氧化反应;用Li3V2(PO4)3作正极材料,负极为Li3C6材料,故A错误;
B. 放电时,M极为负极,电极反应Li3C6-3e-→3Li++6C,外电路中通过0.1 mol电子M极质量减少0.1 mol×7g·mol-1=0.7 g,故B正确;
C. 充电时,Li+向阴极迁移,即向M极区迁移,故C错误;
D. 充电时,N极为阳极,发生氧化反应,Li3V2(PO4)3-3e-=V2(PO4)3+3Li+,故D错误;
故选B。

【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知: ① 硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。
② Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
③ 常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4mol/L的浓硫酸配制500mL2mol/L的硫酸时除用量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有_________________________。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式__________。
(3)过滤II操作得到的滤渣主要为______(填化学式)。
(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_________________。
(5)上述流程中,每还原1molCrO42-时,需要消耗SO2 _______ mol。