题目内容
【题目】下列有关说法不正确的是
A.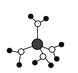 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.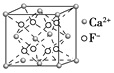 CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
C. H原子的电子云图如图所示为球形
H原子的电子云图如图所示为球形
D. 金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
【答案】B
【解析】
A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,故A正确;
B.由CaF2晶体的晶胞可知,与每个Ca2+距离最近的F-为8个,故B错误;
C.H原子最外层只有一个电子,电子云密度表示电子在某一区域出现的机会的多少,H原子的电子云为球形,故C正确;
D.在金属晶体Cu的最密堆积中,对于每个Cu原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个Cu原子的配位数均为12,故D正确;
故答案选B。

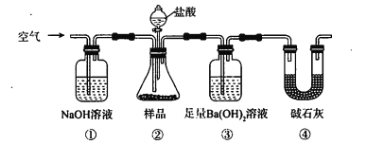
【题目】Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如图(a为活塞,加热及固定装置已略去)。

(1)连接仪器、___、加药品后,打开 a,然后滴入浓硫酸,加热;
(2)铜与浓硫酸反应制备 SO2的化学方程式是___;
(3)品红溶液中的实验现象是___;
(4)从高锰酸钾溶液中观察到的现象说明 SO2具有___性。
Ⅱ、上述实验中 NaOH 溶液用于吸收剩余的 SO2 生成 Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性溶液中Br2氧化Na2SO3的离子方程式___
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告。___
限选试剂:2mol·L-1HCl;1mol·L-1H2SO4;lmol·L-1BaCl2;lmol·L-1Ba(NO3)2;0.1mol·L-1AgNO3;CCl4;新制氯水。
编号 | 实验操作 | 预期现象和结论 |
步骤① | 取少量待测液加入试管中,加入过量的2mol·L-1盐酸,再滴加 | 有 生成,证明待测液中SO42- |
步骤② | 取出步骤①中适量上层清液于试管中,加入适量氯水,再加入 ,振荡,静置。 | 下层液体呈 ,证明待测液中含Br-。 |
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___。
(2)上述反应中氧化剂是___(填化学式),被氧化的元素是___(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___L。
(5)下列离子方程式的书写及评价均合理的是___。
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
(6)将一定量Mg、Al合金溶于1mol·L-1的HC1溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___。
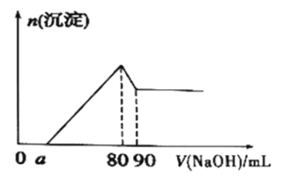
A.溶解“一定量Mg、A1合金”的HC1溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
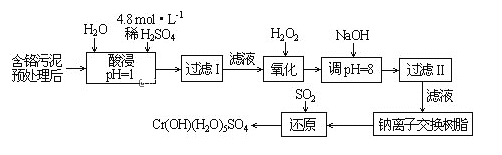
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需______________________。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________。(写出两个措施)
(3)加入H2O2的作用是_____________________________________。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是_______________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________。