题目内容
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g)△H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O![]() FeO+N2;反应②______________
FeO+N2;反应②______________
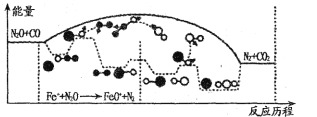
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
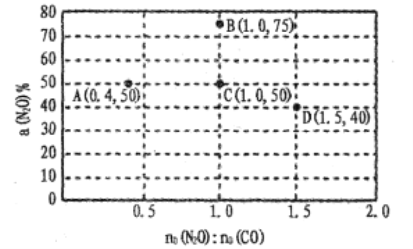
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
【答案】2NH3+2O2![]() N2O+3H2O -163kJ/mol FeO++CO
N2O+3H2O -163kJ/mol FeO++CO![]() CO2+Fe+ 放热 反应① 降低温度 = 1.17
CO2+Fe+ 放热 反应① 降低温度 = 1.17
【解析】
(2)利用盖斯定律求反应热;
(3)根据总反应减去反应①得到反应②;根据反应物和生成物的相对能量判断反应热;根据活化能的相对大小判断化学反应速率大小,从而确定决速步;
(4)根据不同温度下的平衡常数的大小,判断温度的变化;
(5)根据三等式求算平衡常数。
(1)NH3和O2反应得到N2O,根据化合价升降守恒配平,NH3中N的化合价从-3升高到N2O中的+1,共升高4价;O2中O的化合价从0降低到-2,共降低4价,化合价升降守恒,则NH3和O2的系数比为1:1,根据原子守恒配平,可得2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2) 已知①2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol,②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol;反应①×![]() -反应②×
-反应②×![]() 可得目标反应,则△H=△H1×
可得目标反应,则△H=△H1×![]() -△H2×
-△H2×![]() =-1010kJ/mol×
=-1010kJ/mol×![]() -(-1531kJ/mol)×
-(-1531kJ/mol)×![]() =-163kJ/mol;
=-163kJ/mol;
(3)总反应为N2O(g)+CO(g)![]() CO2(g)十N2(g),实际过程是分2步进行,因此反应①和反应②相加得到总反应,则反应②等于总反应减去反应①,可得反应②为FeO++CO
CO2(g)十N2(g),实际过程是分2步进行,因此反应①和反应②相加得到总反应,则反应②等于总反应减去反应①,可得反应②为FeO++CO![]() CO2+Fe+;
CO2+Fe+;
根据反应历程图可知,反应物的总能量大于生成物的总能量,则该两步反应均为放热反应;
根据反应①的历程图可知,由Fe+和N2O经过过渡态得到产物FeO+和N2,过渡态和反应物Fe+和N2O的能量差为反应①的活化能,同理,可知反应②的活化能,可知,反应①的活化能大于反应②的活化能,活化能越大,化学反应速率越慢,而化学反应速率慢的步骤为决速步,决定反应达到平衡所用时间,即反应①决定反应达到平衡所用时间;
(4)①根据图像,C点和B点,反应物的投料比相同,但是B点表示的平衡状态,N2O的转化率高于C点,C点的平衡状态改变为B点的平衡状态,平衡正向移动,N2O的转化率增加;B和C点的反应物投料比相同,因此不是改变反应物的浓度;反应前后的气体体积不变,因此压强不影响平衡移动,只能是温度,该反应为放热反应,平衡正向移动,因此采取的措施是降低温度;
①利用三等式求出C和D点平衡状态的平衡常数,从而比较温度大小;
设定容器体积的体积为VL。
C点的平衡状态其反应物的投标比为1,则设N2O和CO的物质的量均为1mol,其N2O的转化率为0.50,则根据三等式有
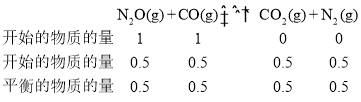 ,则在平衡常数
,则在平衡常数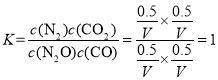 ;
;
D点的平衡状态其反应物的投标比为1.5,则设N2O和CO的物质的量为1.5mol和1mol,其N2O的转化率为0.40,N2O反应了1.5mol×0.40=0.6mol,则根据三等式有
 ,则在平衡常数
,则在平衡常数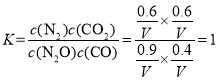 ;
;
C点和D点表示的平衡状态的平衡常数相同,则温度相同,有TC=TD;
(5)根据表格的数据,开始时CO的物质的量分数为50.0%,则设CO和N2O的物质的量各位1mol,假设到达平衡时,CO转化了xmol,根据三等式有
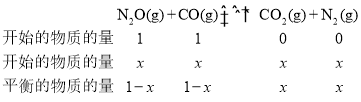 ,达到平衡时,CO的物质的量分数为24.0%,则有
,达到平衡时,CO的物质的量分数为24.0%,则有![]() ,解得x=0.52mol,则平衡常数
,解得x=0.52mol,则平衡常数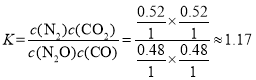 。
。

 科学实验活动册系列答案
科学实验活动册系列答案