题目内容
【题目】【化学选修2 -化学与技未】
I.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2 、A12O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:
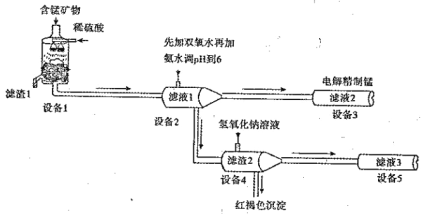
(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。 滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:

①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__ ___。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。

II.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质。由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
离子 | Fe3+ | Fe2 + | Cu2+ |
开始沉淀pH | 1.9 | 7.0 | 6.7 |
沉淀完全pH | 3.4 | 9.0 | 10.0 |
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是 。
(2)溶液1的成分是 ,若向其中通入足量的CO2可以析出的沉淀是 ,此时溶液中的溶质将变成 。
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为: 。
(4)溶液2调节的pH范围为 。
(5)对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3。检验红褐色沉淀是否洗净的方法是 。
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为: ;当两极共产生标准状况下44.8 L气体且阴阳两极产生的气体体积之比为1: 1时,则析出的铜的质量为 。
【答案】Ⅰ.(1)SiO2 ;(2)2Fe2+ + MnO2+4H+ === 2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+ === 2Fe3++Mn2++CO2↑+4H2O;(3)将Fe2+完全氧化为Fe3+; 取滤液2于试管中,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+。(4)滤渣2中存在Al(OH)3,存在电离平衡: Al3+ + 3OH-![]() Al(OH)3
Al(OH)3![]() AlO2- + H+ + H2O ,加入NaOH溶液,H+被中和,浓度减低, Al(OH)3不断溶解;(5)①负极;4OH--4e- ===2H2O+O2↑或者2H2O-4e-=O2↑+4H+ ;② Mn2++2H2O-2e- === MnO2+4H+ ;Ⅱ.(1)升高温度或者增大浸取剂浓度等;(2)NaAlO2、Na2SiO3、NaOH;H2SiO3、Al(OH)3;NaHCO3;(3)2H+ + Cu2S + 5H2O2 === 2Cu2+ + SO42- + 6H2O;2H+ + 2FeS + 9H2O2 === 2Fe3+ + 2SO42- + 10H2O;(4)3.4≤pH<6.7;(5)取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净;(6)2CuSO4 + 2H2O
AlO2- + H+ + H2O ,加入NaOH溶液,H+被中和,浓度减低, Al(OH)3不断溶解;(5)①负极;4OH--4e- ===2H2O+O2↑或者2H2O-4e-=O2↑+4H+ ;② Mn2++2H2O-2e- === MnO2+4H+ ;Ⅱ.(1)升高温度或者增大浸取剂浓度等;(2)NaAlO2、Na2SiO3、NaOH;H2SiO3、Al(OH)3;NaHCO3;(3)2H+ + Cu2S + 5H2O2 === 2Cu2+ + SO42- + 6H2O;2H+ + 2FeS + 9H2O2 === 2Fe3+ + 2SO42- + 10H2O;(4)3.4≤pH<6.7;(5)取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净;(6)2CuSO4 + 2H2O ![]() 2Cu+ O2↑+ 2H2SO4;64g。
2Cu+ O2↑+ 2H2SO4;64g。
【解析】
试题分析:I.设备1中加入硫酸,MnCO3、FeCO3、Al2O3都与硫酸反应反应,因为滤液中锰以+2价存在,说明MnO2发生氧化反应,MnO2在酸性条件下Fe2+氧化成Fe3+,SiO2属于酸性氧化物,不与硫酸反应,因此滤渣为SiO2;(2)根据(1)的分析,MnO2中+4价锰具有氧化性,Fe2+具有还原性,两者发生氧化还原反应,因此离子反应方程式为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;(3)利用双氧水的强氧化性,把Fe2+全部氧化成Fe3+,验证Fe2+的存在,用铁氰化钾溶液,如果有蓝色沉淀产生,说明有Fe2+,否则没有Fe2+,也可以用高锰酸钾溶液,如果酸性高锰酸钾溶液褪色,说明Fe2+,否则不含Fe2+;(4)滤渣中含有Al(OH)3、Fe(OH)3,Al(OH)3属于两性化合物,AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-,加入NaOH溶液,OH-消耗H+,促使平衡向逆反应方向进行,促使Al(OH)3溶解;(5)①此装置为电解装置,根据电解原理,阴离子向阳极移动,则A为负极,B为负极,阳极应是阴离子放电,电极反应式2H++2e-=H2↑;②阳极发生氧化反应,Mn2+-2e-+2H2O=MnO2++4H+;II.(1)一般温度升高,溶解度增大,可以采用升高温度的方法,达到提高浸出,或者说适当提高浸取剂的浓度;(2)根据冰铜矿的成分,Cu2S、FeS不和氢氧化钠反应,Al2O3属于两性氧化物、SiO2属于酸性氧化物,和碱反应生成NaAlO2、Na2SiO3,所加氢氧化钠过量,因此滤液中有NaAlO2、Na2SiO3、NaOH,碳酸的酸性强于硅酸和偏铝酸,因此析出的沉淀为Al(OH)3、H2SiO3,因为通入的CO2足量,因此生成的溶质为NaHCO3;(3)因为过氧化氢表现强氧化性,因此发生的反应是:2H+ + Cu2S + 5H2O2 === 2Cu2+ + SO42- + 6H2O;2H+ + 2FeS + 9H2O2 === 2Fe3+ + 2SO42- + 10H2O;(4)根据流程调节pH,得到红褐色沉淀,以及各离子沉淀的范围,因此3.4≤pH<6.7;(5)取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净;(6)根据电解的原理,电解CuSO4溶液的化学反应方程式为:2CuSO4 + 2H2O
Al3++3OH-,加入NaOH溶液,OH-消耗H+,促使平衡向逆反应方向进行,促使Al(OH)3溶解;(5)①此装置为电解装置,根据电解原理,阴离子向阳极移动,则A为负极,B为负极,阳极应是阴离子放电,电极反应式2H++2e-=H2↑;②阳极发生氧化反应,Mn2+-2e-+2H2O=MnO2++4H+;II.(1)一般温度升高,溶解度增大,可以采用升高温度的方法,达到提高浸出,或者说适当提高浸取剂的浓度;(2)根据冰铜矿的成分,Cu2S、FeS不和氢氧化钠反应,Al2O3属于两性氧化物、SiO2属于酸性氧化物,和碱反应生成NaAlO2、Na2SiO3,所加氢氧化钠过量,因此滤液中有NaAlO2、Na2SiO3、NaOH,碳酸的酸性强于硅酸和偏铝酸,因此析出的沉淀为Al(OH)3、H2SiO3,因为通入的CO2足量,因此生成的溶质为NaHCO3;(3)因为过氧化氢表现强氧化性,因此发生的反应是:2H+ + Cu2S + 5H2O2 === 2Cu2+ + SO42- + 6H2O;2H+ + 2FeS + 9H2O2 === 2Fe3+ + 2SO42- + 10H2O;(4)根据流程调节pH,得到红褐色沉淀,以及各离子沉淀的范围,因此3.4≤pH<6.7;(5)取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净;(6)根据电解的原理,电解CuSO4溶液的化学反应方程式为:2CuSO4 + 2H2O ![]() 2Cu+ O2↑+ 2H2SO4;因为两极上都产生气体,因此电解完CuSO4后,电解H2O,电解的第一阶段:阴极:Cu2++2e-=Cu,阳极:4OH--4e-=2H2O+O2↑,第二阶段:阴极:2H++2e-=H2↑,阳极:4OH--4e-=2H2O+O2↑,根据题目信息,以及得失电子数目守恒,推出n(Cu2+)=1mol,m(Cu)=64g。
2Cu+ O2↑+ 2H2SO4;因为两极上都产生气体,因此电解完CuSO4后,电解H2O,电解的第一阶段:阴极:Cu2++2e-=Cu,阳极:4OH--4e-=2H2O+O2↑,第二阶段:阴极:2H++2e-=H2↑,阳极:4OH--4e-=2H2O+O2↑,根据题目信息,以及得失电子数目守恒,推出n(Cu2+)=1mol,m(Cu)=64g。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。