��Ŀ����
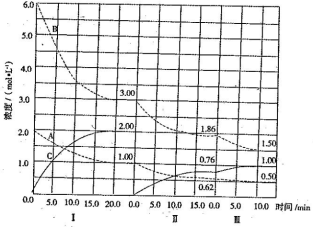
����Ŀ����ӦaA(g) +bB(g)![]() cC(g)( ��H <0)�ڵ��������½��С��ı�������Ӧ��������I������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
cC(g)( ��H <0)�ڵ��������½��С��ı�������Ӧ��������I������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
�ش�����:
(1)��Ӧ�Ļ�ѧ����ʽ�У�a:b:cΪ ��
(2)A��ƽ����Ӧ����vI (A)��v��(A)��v��(A)�Ӵ�С���д���Ϊ ��
(3)B��ƽ��ת����![]() I (B)��
I (B)��![]() ��(B)��
��(B)��![]() �� (B)����С���� ����ֵ�� ��
�� (B)����С���� ����ֵ�� ��
(4)�ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ����� ����ȡ�Ĵ�ʩ�� ��
��5���Ƚϵ����η�Ӧ�¶�(T2)�͵����η�Ӧ�¶ȣ�T3)�ĸߵ�:T2 T3(���� >��=��< ��)�жϵ������� ��
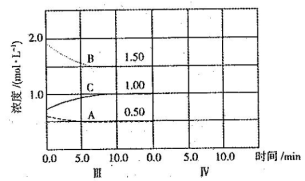
��6���ﵽ������ƽ����������������һ�����ٶ�10 min��ﵽ�µ�ƽ�⣬������ͼ�������߱�ʾ��IV����ϵ�и����ʵ�Ũ����ʱ��仯�����ƣ������ϱ����� A��B��C)��
���𰸡�(1)1��3��2��(2)v��(A)��v��(A)��v��(A)��(3)����(B)��0.19(19%)��
(4)������Ӧ�������ӷ�Ӧ��ϵ���Ƴ�����C��
(5)�����˷�ӦΪ���ȷ�Ӧ�������¶���ƽ��������Ӧ�����ƶ�
(6)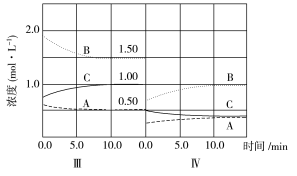
(ע��ֻҪ�����ܱ�ʾ��ƽ�����淴Ӧ�����ƶ���������Ũ�ȵ���Ա仯��������)��
��������
�����������1�����ݻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���Ϊͬһ�����ⶨ��������ʵ���Ũ�ȱ仯���ڻ�ѧ������֮�ȣ�a��b��c=(2��1)��(6��3)��2=1��3��2����2�����ŷ�Ӧ�Ľ��У�A��Ũ�Ȳ��ϼ�С��Ũ�ȼ�С����Ӧ���ʼ�������v��(A)��v��(A)��v��(A)����3������ת���ʵĶ��壬��I(B)=(6��3)/6��100%��50%����II(B)=(3��1.86)/3��100%=38%����III(B)=(1.86��1.5)/1.86��100%=19.4%�������III(B)��С����4����II�ε�ͼ��C��0��ʼ��˲��AB��Ũ�Ȳ��䣬��˷�Ӧ������Ӧ������У��Ӳ������Ƴ�C����5������A��B�������٣�C�������ӣ����жϴ�ƽ��������Ӧ�����ƶ�����Ӧ�Ǹı�Ũ�ȣ���Ϊ�ݻ��������������˸ı�ѹǿҲ�����ܣ�ֻ���Ǹı��¶ȣ���˴˷�Ӧ�Ƿ��ȷ�Ӧ��������������ԭ����Ӧ�ǽ����¶ȣ���T2>T3��(6)�������һ����ѹǿ����һ����Ũ�ȱ�Ϊԭ����1/2����Сѹǿ��ƽ�����淴Ӧ�����ƶ�������ֵ����ʵ���Ũ�ȱ仯��֮�ȵ��ڻ�ѧ�������ȣ����ͼ���ǣ� ��
��

 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�����Ŀ������ѧѡ��2 -��ѧ�뼼δ��
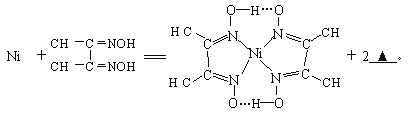
I.ij���̿������Ҫ�ɷ���MnCO3��MnO2��FeCO3��SiO2 ��A12O3�ȡ���֪FeCO3��MnCO3������ˮ��һ������������Ĥ��ⷨ���¼��������ڴ�̼���̿�����ȡ�����̣���Ҫ����ת����ϵ���£�

(1)�豸���з�Ӧ����Һ1����Ԫ��ֻ��Mn2+����ʽ���ڣ�������1��Ҳ��MnO2�� ����1����Ҫ�ɷ��� (�ѧʽ����
(2)�豸1�з���������ԭ��Ӧ�����ӷ���ʽ�� ��
(3)�豸2�м�����˫��ˮ�������� �����ʵ�鷽��������Һ2���Ƿ����Fe2+: ��
(4)�豸4�м����������������Һ�����������ܽ⣬�û�ѧƽ���ƶ�ԭ������ԭ�� ��
��5���豸3����������Ĥ����ȡ�����̵ĵ��װ����ͼ��

�����װ���м�ͷ��ʾ��Һ���������ƶ��ķ���;��A�缫��ֱ����Դ�� ����ʵ�������У�������ϡ����Ϊ���Һ�������ĵ缫��ӦʽΪ__ ___��
���ù���֮���Բ��������ӽ���Ĥ����Ϊ�˷�ֹMn2+ ������������������Ӧ����MnO2�����Դ�˷ѣ�д���ø���Ӧ�ĵ缫��Ӧʽ ��

II.��ͭ�����Ҫ�ɷ���Cu2S��FeS,��������Al2O3��SiO2���ʡ��ɱ�ͭ��ұ������ͭ����������:
��֪�����ӳ����ķ�Χ���±�
���� | Fe3+ | Fe2 + | Cu2+ |
��ʼ����pH | 1.9 | 7.0 | 6.7 |
������ȫpH | 3.4 | 9.0 | 10.0 |
��ش��������⣺
��1������ͭ������Ŀ������߽����ʣ�����һ����߽����ʵĴ�ʩ�� ��
��2����Һ1�ijɷ��� ����������ͨ��������CO2���������ij����� ����ʱ��Һ�е����ʽ���� ��
��3������1����H2O2��ϡH2SO4����Һ��������ֻ��SO42-��������������Cu2+ ��F3+����ù��̵����ӷ���ʽΪ: ��
��4)��Һ2���ڵ�pH��ΧΪ ��
��5���Ժ��ɫ��������ϴ�Ӳ����ﴦ�������Եõ�������Fe(OH)3���������Ʊ���ɫ����Fe2O3��������ɫ�����Ƿ�ϴ���ķ����� ��
(6)�ö��Ե缫����Һ3���е�⣬���CuSO4��Һ�Ļ�ѧ����ʽΪ�� ����������������״����44.8 L���������������������������֮��Ϊ1: 1ʱ����������ͭ������Ϊ ��
����Ŀ��ij�¶��£���Ӧ2A(g) ![]() B(g)+C(g)��ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A(g)��20sʱ��ø���ֵ����ʵ������±�������˵����ȷ������ ��
B(g)+C(g)��ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A(g)��20sʱ��ø���ֵ����ʵ������±�������˵����ȷ������ ��
���� | A(g) | B(g) | C(g) |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A����Ӧǰ20s��ƽ������Ϊv(A)=0.6mol��L��1��S��1
B��20sʱ������Ӧ���ʵ����淴Ӧ����
C����ƽ��ʱ��A(g)��ת����Ϊ100%
D���������¶ȣ�ƽ�ⳣ������Ϊ0.5����Ӧ����H��0