题目内容
【题目】在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
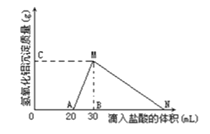
(1)此溶液中同时含有____________mol______离子;
(2)用离子方程式表示MN段发生的反应是________________________
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)________________
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为__________mL
【答案】(1)0.02mol;OH-
(2)Al(OH)3+3H+=Al3++3H2O
(3)1mol(4)60ml
【解析】
试题分析:(1)由图可知,滴加盐酸开始不产生沉淀,故溶液中还含有OH-,开始加入的20mL盐酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)=n(H+)=0.02L×1mol/L=0.02mol,
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
(3)由图可知,从20mL~40mL发生的反应为AlO2-+H++H2O═Al(OH)3↓,该阶段消耗的盐酸体积为40mL-20mL=20mL,由方程式可知溶液中n(AlO2-)=n(H+)=0.01L×1mol/L=0.01mol,故c(AlO2-)=0.01mol/.0.01L=1mol/L,
(4)由图可知,加盐酸到点N处,氢氧化铝恰好完全溶解,此时溶液中阴离子为Cl-,根据电荷守恒可知n(Cl-)=n(AlO2-)+n(OH-)=0.01mol+0.02mol=0.03mol,故此阶段消耗的盐酸的体积为0.03mol/1(mol/L) =0.03L=30mL,故N点滴入的HCl溶液体积共为30mL+30mL=60mL。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】【化学选修2 -化学与技未】
I.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2 、A12O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:
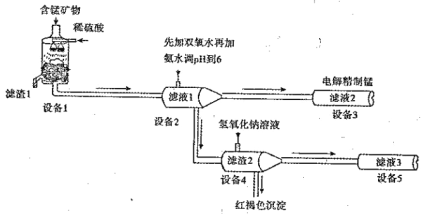
(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。 滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:

①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__ ___。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。

II.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质。由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
离子 | Fe3+ | Fe2 + | Cu2+ |
开始沉淀pH | 1.9 | 7.0 | 6.7 |
沉淀完全pH | 3.4 | 9.0 | 10.0 |
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是 。
(2)溶液1的成分是 ,若向其中通入足量的CO2可以析出的沉淀是 ,此时溶液中的溶质将变成 。
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为: 。
(4)溶液2调节的pH范围为 。
(5)对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3。检验红褐色沉淀是否洗净的方法是 。
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为: ;当两极共产生标准状况下44.8 L气体且阴阳两极产生的气体体积之比为1: 1时,则析出的铜的质量为 。