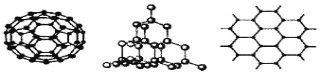
题目内容
【题目】下列关于乙烯和乙烷的说法中,不正确的是( )
A. 乙烯属于不饱和链烃,乙烷属于饱和链烃
B. 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,所有原子不在同一平面上
C. 乙烯分子的C=C键中有一个键容易断裂
D. 乙烯分子的C=C键都容易断裂
【答案】D
【解析】试题分析:A.乙烯含有碳碳双键,属于不饱和烃,乙烷属于饱和烃,正确;B.甲烷是正四面体结构,所以乙烷中所有原子不可能在同一平面上;乙烯为平面结构,所有原子都处在同一平面上,正确;C.乙烯分子的C=C键中两个键结合的牢固程度不相同,其中有一个键容易断裂,另一个容易断裂,正确;D.乙烯分子的C=C键中结合的牢固程度不相同,因此不都容易断裂,错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】【化学选修2 -化学与技未】
I.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2 、A12O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:
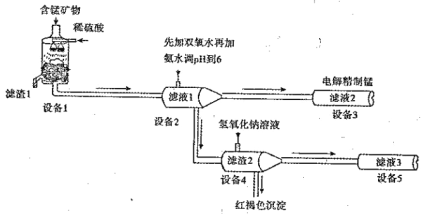
(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。 滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:

①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__ ___。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。

II.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质。由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
离子 | Fe3+ | Fe2 + | Cu2+ |
开始沉淀pH | 1.9 | 7.0 | 6.7 |
沉淀完全pH | 3.4 | 9.0 | 10.0 |
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是 。
(2)溶液1的成分是 ,若向其中通入足量的CO2可以析出的沉淀是 ,此时溶液中的溶质将变成 。
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为: 。
(4)溶液2调节的pH范围为 。
(5)对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3。检验红褐色沉淀是否洗净的方法是 。
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为: ;当两极共产生标准状况下44.8 L气体且阴阳两极产生的气体体积之比为1: 1时,则析出的铜的质量为 。
【题目】肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___________.
(2)实验室用两种固体制取NH3的反应化学方程式为_____________.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_____________.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为_____________.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变△H_________0(填“>”、“<”或“=”).
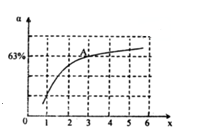
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是_____________.图中A点处,NH3的平衡转化率为___________.
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)2NH3(g),测得甲容器中H2的平衡转化率为40%.
n(N2) | n(H2) | n(NH3) | |
甲 | 1mol | 3mol | 0mol |
乙 | 0.5mol | 1.5mol | 1mol |
丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是_____________(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为_____________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式: ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为 {已知Ksp[Mg(OH)2]=4.0×10-12]}