题目内容
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
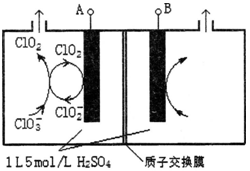
(2)目前已开发出用电解法制取ClO2的新工艺。
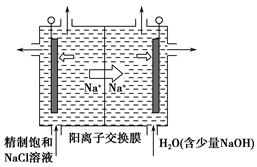
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为_____________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m3这种污水,至少需要ClO2________mol。
(1)①B ②0.1 (2)①Cl--5e-+2H2O=ClO2↑+4H+
②0.01 在阴极上发生反应2H++2e-=H2↑,H+浓度减小,使得H2O
OH-+H+的平衡向右移动,OH-浓度增大,pH增大
(3)2ClO2+2CN-=N2↑+2CO2↑+2Cl- 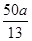
解析

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
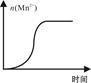
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
 PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
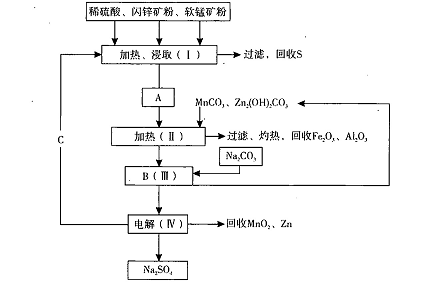
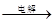 MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。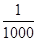 的氰酸盐(含CNO-)。
的氰酸盐(含CNO-)。