题目内容
(12分)D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g)  2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
(1)第三周期第ⅦA族; (2)碱性;S2-+H2O HS-+OH-;2H++2e-=H2↑;
HS-+OH-;2H++2e-=H2↑;
(3) 2Na2O2+2CO2 =Na2CO3+ O2 ; Na2O2; (4)吸收395.1KJ的热量(或+395.1KJ)
解析试题分析:根据题意可知这几种元素分别是:A是Na;B是S;C是Cl;D是O。(1)Cl元素在周期表中的位置是位于第三周期第ⅦA族;(2)A、B元素形成的常见化合物Na2S是强碱弱酸盐,弱酸根离子水解使水溶液显碱性。水解的两种方程式为:S2-+H2O HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
考点:考查元素的推断、盐的水解、电解原理的应用、还原剂的判断、热化学方程式的书写的知识。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
请回答:
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-22 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。(5)在溶液N中加入乙醇的目的是 。
某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O
 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。 (15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)该工艺流程中,可以循环利用的物质有 和 。
 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?) (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
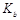 = mol·L-1。
= mol·L-1。