题目内容
某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O
 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
解析试题分析:(1)读表2中信息,以1L废水为研究对象,其中含有29.4gH2SO4,由于硫酸的相对分子质量为98,m/M=n,则n(H2SO4)=29.4g÷98g/mol=0.3mol,由于c=n/V,则c(H2SO4)=0.3mol÷1L=0.3mol/L;(2)FeAsO4是难溶盐,废水中存在其沉淀溶解平衡:FeAsO4 (s) Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)?c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s)
Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)?c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s) Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)
Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)  3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4
3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4 H++H2AsO4-、H2AsO4-
H++H2AsO4-、H2AsO4- H++HAsO42-、HAsO42-
H++HAsO42-、HAsO42- H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3="[" c(H+)? c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+)? c(OH-),AsO43-+H2O
H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3="[" c(H+)? c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+)? c(OH-),AsO43-+H2O HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)?c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)?c(OH-)? c(H+)]/[ c(H+)?c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)?c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)?c(OH-)? c(H+)]/[ c(H+)?c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
考点:考查含砷等废水处理工艺流程,涉及质量、摩尔质量、物质的量、溶液体积、物质的量浓度、溶度积计算、关键步骤的离子方程式、调解pH分步沉淀的原理、沉淀的成分、解释原因、电离平衡常数、水的离子积、盐类水解平衡常数的计算等。

在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g) mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度____________0.09 mol/L(填“<”、“=”或“>”)。
(3)在80℃时该反应的平衡常数K值为 (保留1位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②A与B的浓度之比越大
③B的产量越大 ④正反应进行的程度越大
用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 22.60 |
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);

(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。
 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。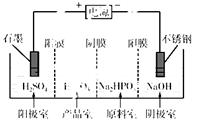
 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。