题目内容
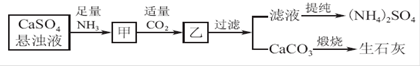
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: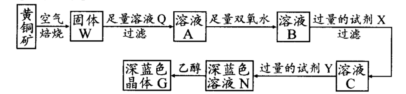
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-22 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。(5)在溶液N中加入乙醇的目的是 。
(共14分)
(1)将黄铜矿粉碎、升高温度、增大空气流速等(2分)[对一点给1分]
(2)2Fe2++2H++H2O2=2Fe3++2H2O(2分)[配平错误或化学式写错0分]
CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种(2分)
(3)1×10-5 mol/L(2分)
取一小片pH试纸放在玻璃片或表面皿上,用玻璃捧或胶头滴管取待测液点在pH试纸中部,待颜色变化稳定后与标准比色卡对比,读出pH值。(2分)
(4) 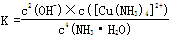 (2分)
(2分)
(5)降低G的溶解度,促进深蓝色晶体析出(2分)
解析试题分析:
(1)增大同体接触面积,升高温度,增大空气流速即增大氧气浓度均能加快化学反应速率。
(2)从数据看,除去铁元素,应将+2价铁转化为+3价铁,加入双氧水可达到此目的。Fe3+水解能力比Cu2+强:Fe3++3H2O Fe(OH)3+3H+,加入氧化铜、氢氧化铜、碳酸铜或碱式碳酸铜等消耗生成的酸,促使Fe3+完全水解,过滤除去过量的CuO和氢氧化铁即可。
Fe(OH)3+3H+,加入氧化铜、氢氧化铜、碳酸铜或碱式碳酸铜等消耗生成的酸,促使Fe3+完全水解,过滤除去过量的CuO和氢氧化铁即可。
(3)由电离常数表达式计算可得。
(4)书写时,氢氧化铜固体和水不计入表达式。
(5)深蓝色晶体的主要成分是[Cu(NH3)4]SO4·H2O,加入乙醇的目的是降低其溶解度,促进晶体析出。
考点:本题以工艺流程为基础,考查了化学实验基本操作、氧化还原理论、化学平衡理论等相关知识。

我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程: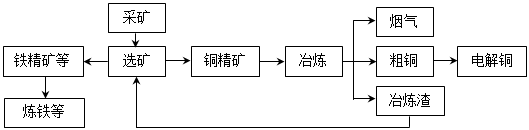
冶炼中的主要反应:Cu2S + O2 =" 2Cu" + SO2
(1)烟气中的主要废气是________________,从提高资源利用率和减排考虑,其综合利用方式是制___________。
(2)电解法炼铜时,阳极是____________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式在电解槽_______________(填“阳极”或“阴极”的槽底,阴极的电极反应式是_________________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(KSP):
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是______________。
一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为___________________________________________________________________________。
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
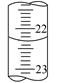
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: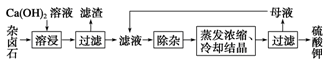

 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: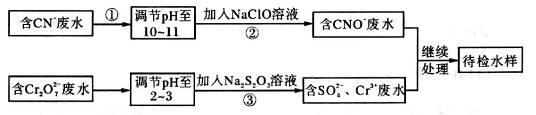
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol