题目内容
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为  (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
(1)xCOS(g)=XCO(g)+Sx(s)△H=0.5x(b-a)akJ/mol
(2)3NA
(3) ①HS-(或NaHS)
② c
③ c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+)
(4)①SO2+xI2+2H2O=H2SO4+2HIx
②2Ix—-2e-=xI2 2HIx=(x-1)I2+2HI
解析

(14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )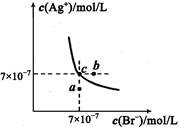
| A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816 AgBr(s)+Cl-(aq)平衡常数Κ≈816 |
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。