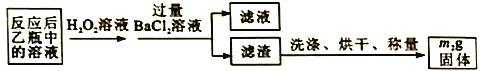
题目内容
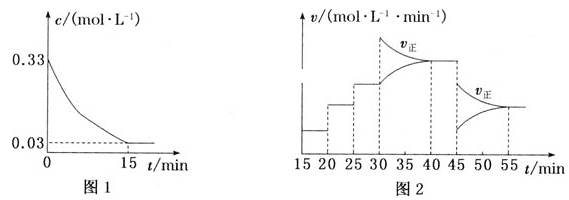
【题目】电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原理如下图所示。下列说法不正确的是

A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
【答案】B
【解析】
遇到本题考查电解池有关的性质,首先从a极产物为O2,判断a极为阳极,b极为阴极,电解池中阳离子从阴极移向阳极、阳离子从阳极移向阴极,但是本题是阳离子交换膜,仅允许阳离子通过。
A.a极产生O2,a极发生氧化反应,a极为阳极,则b极为阴极,发生还原反应,反应式为2H2O+2e-= H2+2OH-,A正确;
B.电解池中阳离子移向阴极,溶液中的Na+通过交换膜由a极室到b极室,B错误;
C. 水是弱电解质,导电性比较弱,B可以使用稀NaOH溶液,增强溶液的导电性,C正确;
D.a极电极反应为2H2O-4e-=4H++O2↑、H++CO32-=HCO3-,总的离子方程式为:4CO32-+2H2O-4e-=4HCO3-+O2↑,D正确;
答案选B。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛。
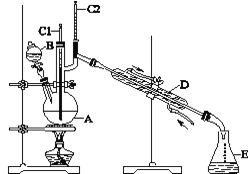
发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为_______。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是___________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。