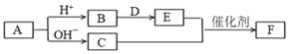
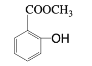
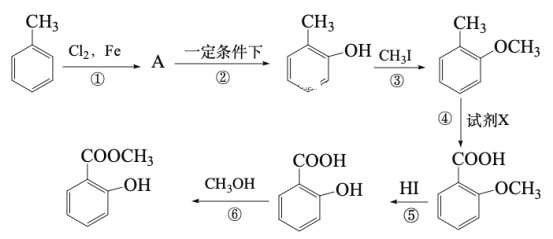
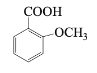
题目内容
【题目】依据氧化还原反应:2Ag+(aq) +Cu(s) =Cu2+(aq) +2Ag(s)设计的原电池如图所示。请回答下列问题:
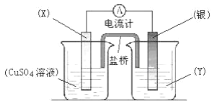
(1)电极 X 的材料是_____; 电解质溶液 Y 是________;
(2)银电极为电池的_____极,发生的电极反应为____________X 电极上发生的电极反应为__________
(3)外电路中的电子是从_____电极流向_____电极。
【答案】Cu AgNO3 正 Ag++e=Ag Cu2e=Cu2+ Cu Ag
【解析】
根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极。
(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,因此电极X为铜;Ag+在正极上得电子被还原,电解质溶液为AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,X为负极:Cu2e=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极。

 阶梯计算系列答案
阶梯计算系列答案【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(3)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)