题目内容
【题目】常温下,电解质溶液中的下列关系式不正确的是( )
A.0.1molL-1 CH3COOH溶液加水稀释,n(H+)增大
B.在0.1molL-1的氨水中滴加0.1molL-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-amolL﹣1
C.将cmolL-1的醋酸溶液与0.02molL-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D.已知A-+H2B(过量)═HA+HB-,则结合H+的能力:A-<HB-<B2-
【答案】D
【解析】
根据题中电解质溶液可知,本题考查弱电解质的电离平衡及电离平衡常数,运用影响电离平衡规律和电离平衡常数计算公式分析。
A. 0.1molL-1 CH3COOH溶液加水稀释,促进醋酸电离,n(H+)增大,A项正确;
B.在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和生成氯化铵,铵根离子水解促进了水的电离,此时pH=a,则溶液中水电离的(OH-)=c(H+)=10-amol·L-1,B项正确;
C.反应后溶液呈中性,则(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01 mo/L,根据物料守恒,反应后溶液中醋酸的浓度为:(![]() -0.01)mo/L,所以用含c的代数式表示CH3COOH的电离常数为:Ka=
-0.01)mo/L,所以用含c的代数式表示CH3COOH的电离常数为:Ka=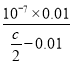 =
=![]() , C项正确;
, C项正确;
D.酸性:H2B>HB->HA,酸性越强,其阴离子结合质子的能力越弱,则A->B2-->HB-,D项错误;
答案选D。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目