题目内容
15. 白云石的主要成份是CaCO3•MgCO3,在我国有大量的分布.以白云石为原料生产的钙镁系列产品有广泛的用途.白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应是放热反应,化学方程式如下:
白云石的主要成份是CaCO3•MgCO3,在我国有大量的分布.以白云石为原料生产的钙镁系列产品有广泛的用途.白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应是放热反应,化学方程式如下:Ca(OH)2+Mg(OH)2+3CO2?CaCO3+Mg(HCO3)2+H2O
完成下列填空
(1)Ca(OH)2的碱性比Mg(OH)2的碱性强(选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度大(选填“大”或“小”)
(2)碳化温度保持在50~60℃.温度偏高不利于碳化反应,原因是二氧化碳的溶解度小、碳酸氢镁分解.温度偏低也不利于碳化反应,原因是反应速率较小.
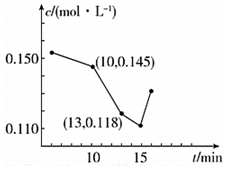
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10min到13min之内钙离子的反应速率为0.009mol/(L•min).15min之后钙离子浓度增大,原因是CaCO3+CO2+H2O=Ca(HCO3)2(用化学方程式表示).
(4)Mg原子核外电子排布式为1s22s22p63s2;Ca原子最外层电子的能量高于Mg原子最外层电子的能量.(选填“低于”、“高于”或“等于”)
分析 (1)金属性越强,对应的最高价的氧化物的水化物的碱性越强,氢氧化钙微溶于水,而氢氧化镁难溶;
(2)温度过高,二氧化碳的溶解度减小,且碳酸氢镁不稳定,如温度过低,反应速率较小;
(3)在10min到13min之内钙离子浓度由0.145mol/L变化为0.118mol/L,结合v=$\frac{△c}{△t}$计算速率;15min之后钙离子浓度增大,原因是二氧化碳与碳酸钙反应生成碳酸氢钙;
(4)Mg原子核外有12个电子,Ca原子核外电子层数比Mg多,原子半径大,最外层电子距离原子核较远.
解答 解:(1)金属性Ca>Mg,金属性越强,对应的最高价的氧化物的水化物的碱性越强,则Ca(OH)2的碱性比Mg(OH)2的碱性强,
氢氧化钙微溶于水,而氢氧化镁难溶,则Ca(OH)2的溶解度比Mg(OH)2的溶解度大,
故答案为:强;大;
(2)温度过高,二氧化碳的溶解度减小,且碳酸氢镁不稳定,不利于碳化反应,如温度过低,反应速率较小,也不利于不利于碳化反应,
故答案为:二氧化碳的溶解度小;碳酸氢镁分解;反应速率较小;
(3)在10min到13min之内钙离子浓度由0.145mol/L变化为0.118mol/L,v=$\frac{△c}{△t}$=$\frac{0.145mol/L-0.118mol/L}{3min}$=0.009mol/(L•min),
15min之后钙离子浓度增大,原因是二氧化碳与碳酸钙反应生成碳酸氢钙,反应的方程式为CaCO3+CO2+H2O=Ca(HCO3)2,
故答案为:0.009mol/(L•min);CaCO3+CO2+H2O=Ca(HCO3)2;
(4)Mg原子核外有12个电子,子核外电子排布式为1s22s22p63s2,Ca原子核外电子层数比Mg多,原子半径大,最外层电子距离原子核较远,则能量较高,
故答案为:1s22s22p63s2;高于.
点评 本题为2015年上海高考题第四题,综合考查难溶电解质的溶解平衡、化学反应速率以及核外电子排布等知识,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,难度中等.

| A. | 高温、高压、催化剂条件下,1 mol N2与足量H2充分反应转移的电子数为6 NA | |
| B. | 将NO2和NO混合,标准状况下,22.4 L混合气体中所含的氮原子总数为2 NA | |
| C. | 常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Ca2+、NO3- | ||
| C. | Na+、AlO2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCl的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+),c(Cl-)均会减小 |

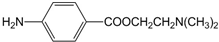 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):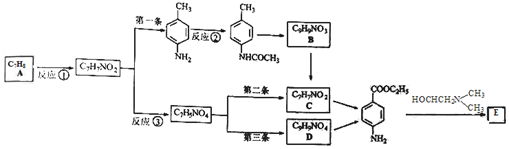
 ;C的名称是对氨基苯甲酸.
;C的名称是对氨基苯甲酸.
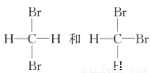 互为同分异构体
互为同分异构体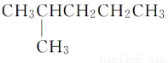 和
和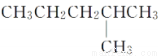 是同一种物质
是同一种物质 H2S+2OH-
H2S+2OH- AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为
AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为