题目内容
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 高温、高压、催化剂条件下,1 mol N2与足量H2充分反应转移的电子数为6 NA | |
| B. | 将NO2和NO混合,标准状况下,22.4 L混合气体中所含的氮原子总数为2 NA | |
| C. | 常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
分析 A.氮气与氢气反应为可逆反应,不能进行到底;
B.依据n=$\frac{V}{22.4}$计算物质的量,结合分子式特征分析计算氮原子数;
C.依据溶液PH和离子积常数计算;
D.氢氧化铁胶体分散质是氢氧化铁的集合体.
解答 解:A.氮气与氢气反应为可逆反应,1 mol N2与足量H2不能完全反应生成2mol氨气,转移的电子数小于6 NA,故A错误;
B.依据n=$\frac{V}{22.4}$计算物质的量=1mol,结合分子式可知氮原子数为NA,故B错误;
C.依据溶液PH和离子积常数计算,常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数=10L×$\frac{1{0}^{-14}}{1{0}^{-12}}$×NA=0.1NA,故C正确;
D.氢氧化铁胶体分散质是氢氧化铁的集合体,将含有1mol FeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目小于NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算,溶液浓度计算分析,题目难度不大.

练习册系列答案
相关题目
19. 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )| A. | 4 min内 v(Z)=0.025 mol•L-1•min-1 | |
| B. | Y的平衡转化率为75% | |
| C. | 平衡常数K=(25/12)(mol•L-1)-2 | |
| D. | t1 min时充入少量He,平衡向正向移动 |
16.下列微粒可以大量共存于同一溶液中的是( )
| A. | Na+、NH4+、AlO2-、SiO32- | B. | Ca2+、NH4+、NH3﹒H2O、CH3COO- | ||
| C. | Cr2O72-、H+、C2H5OH、NO3- | D. | Cu2+、SO42-、HS-、Cl- |
13.化学与生产、生活、社会密切相关,下列说法不正确的是( )
| A. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 | |
| B. | 方便面的制作过程中常用到纯碱,葡萄酒中一般加入少量SO2作为添加剂 | |
| C. | 油脂、淀粉、纤维素、蛋白质等都能在人体内水解并提供能量 | |
| D. | 二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾的主要组成 |
20.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )

| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
14.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
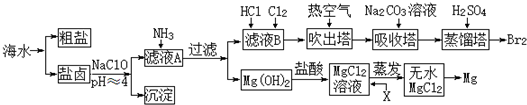
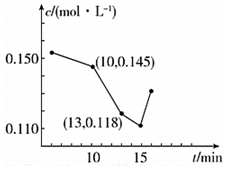 白云石的主要成份是CaCO3•MgCO3,在我国有大量的分布.以白云石为原料生产的钙镁系列产品有广泛的用途.白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应是放热反应,化学方程式如下:
白云石的主要成份是CaCO3•MgCO3,在我国有大量的分布.以白云石为原料生产的钙镁系列产品有广泛的用途.白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应是放热反应,化学方程式如下: