【题目】实验室现有 Fe(OH)3、Cu(OH)2 和少量杂质的固体混合物,某同学欲测定该固体混合物中各成分的含量,设计了如下实验.部分实验步骤如下:
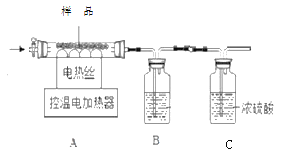
已知:①在 68℃时,Cu(OH)2 会分解;在 500℃时,Fe(OH)3会分解.二种物质的分解产物均为氧化物且化合价不变.
②装置气密性良好,试剂均足量,反应均完全,杂质不参与反应也不分解.
Ⅰ.将质量为m的样品放入硬质玻璃管中,称量装置B的质量.
Ⅱ.连接好装置。缓缓通入N2一会儿,再开始加热并控制温度在100℃左右.反应结束后称量装置B的质量.
Ⅲ.重复步骤Ⅱ,控制温度在550℃左右.反应结束后再次称量装置B的质量.实验数据记录如下表:
温度/℃ | 室温 | 100 | 550 |
B装置/g | m1 | m2 | m3 |
请回答下列问题:
(1)装置B中的试剂是______,装置C的作用是______。
(2)每次停止加热后仍需继续通N2,作用是可防止倒吸和______。
(3)写出步骤Ⅲ发生反应的化学方程式______。
(4)样品中Cu(OH)2的质量分数为______。若步骤Ⅱ中物质反应不完全,则样品中Fe(OH)3的质量分数会______(“偏大”或“偏小”或“无影响”)。
【题目】Cu–Zn合金可用于工艺品的制作。某化学兴趣小组的同学为了测定某铜锌合金样品的组成,取20克样品于烧杯中,向其中分5次加入相同质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量均为20 g,剩余固体的质量记录于下表:
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
反应后剩余固体的质量(g) | 17.4 | 14.8 | 12.2 | 10.8 | 10.8 |
试回答下列问题:
(1)Cu–Zn合金属于___________材料(“金属”或“有机合成”)。
(2)计算Cu–Zn合金完全反应时生成氢气的质量___________。(计算结果保留2位小数)