题目内容
【题目】Cu(NO3)2受热易分解,一种焰火火药中含Cu(NO3)2在燃放时会产生绿色火焰。现已知18.8gCu(NO3)2受热后完全分解生成了固体X、9.2gNO2和1.6gO2,则下列说法不正确的是
A.固体物质X属于氧化物
B.该反应中NO2与O2的分子个数比为4:1
C.该反应的方程式中X与O2的化学计量数之比为4:1
D.该反应中铜元素的化合价没有发生改变
【答案】C
【解析】
根据题意,18.8gCu(NO3)2 受热后完全分解生成了固体 X、9.2gNO2 和 1.6gO2,X的质量为18.8g-9.2g-1.6g=8g。
设该反应的方程式为:xCu(NO3)2![]() yX +zNO2
yX +zNO2![]() +nO2
+nO2![]() 。有如下质量关系:
。有如下质量关系:
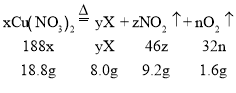
![]()
解得方程式中的系数之比,x:z:n=2:4:1。代入方程式中,根据质量守恒并将方程式配平得,其反应的化学方程式为:2Cu(NO3)2![]() 2CuO+4NO2
2CuO+4NO2![]() + O2
+ O2![]() 。故Cu(NO3)2受热分解生成了氧化铜、二氧化氮和氧气。
。故Cu(NO3)2受热分解生成了氧化铜、二氧化氮和氧气。
A、固体物质X为氧化铜,属于氧化物。故选项说法正确。
B、由分析中方程式得:该反应中 NO2与O2的分子个数比为 4:1,故选项说法正确。
C、由分析中方程式得,该反应的方程式中X与O2的化学计量数之比为2:1。故选项说法错误。
D、硝酸铜中硝酸根为-1价,则铜元素化合价为+2,氧化铜中氧元素为-2价,铜元素化合价为+2,因此该反应中铜元素的化合价没有发生改变,故选项说法正确。
故选:C。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目