题目内容
【题目】烧杯中盛有硫酸铜和稀硫酸的混合溶液共100.0g,向其中慢慢滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法不正确的是

A.ab 段(不含a、b点)对应的溶液中含三种阳离子
B.c 点对应的溶液的质量为 250.2g
C.原混合溶液中硫酸和硫酸铜的质量分别为 9.8g、8.0g
D.向d点对应的溶液中滴加无色酚酞溶液,会变红色
【答案】C
【解析】
由题意可知,向盛有CuSO4和H2SO4的混合溶液100g中滴加10%的NaOH溶液,氢氧化钠首先与稀硫酸反应生成了硫酸钠和水,当稀硫酸反应完后,再与硫酸铜反应生成了氢氧化铜沉淀和硫酸钠。
A、由图象可知,ab段反应是氢氧化钠与稀硫酸反应生成了硫酸钠和水,此时对应的溶液中含三种阳离子Na+、Cu2+、H+。故选项说法正确。
B、由题意可是:与硫酸铜反应的氢氧化钠的质量为:(160.0g-80.0g)×10%=8g,设生成的氢氧化铜的质量为x,反应物硫酸铜的质量为y。
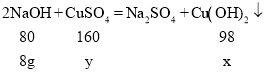
![]()
解得:x=9.8g,y=16g。bc段溶液增加的溶液的质量是80g-9.8g=70.2g,因此c点对应的溶液的质量为100g+80g+70.2g=250.2g。故选项说法正确。
C、设原混合溶液中硫酸的质量为z。

![]()
解得z=9.8g。因此可得原混合溶液中硫酸和硫酸铜的质量分别为9.8g、16.0g。故填选项说法错误。
D、d点氢氧化钠过量溶液显碱性,酚酞试液变红,故选项说法正确。
故选:C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】向烧杯中逐滴加入X溶液至过量,生成沉淀或气体的质量与加入X溶液的质量关系符合如图的是
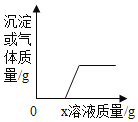
选项 | 烧杯中的物质 | X溶液 |
A | 稀HCl和Na2SO4 | BaCl2溶液 |
B | Cu和Fe | 稀HCl |
C | 稀H2SO4和MgCl2 | NaOH溶液 |
D | NaHCO3和K2SO4 | 稀HCl |
A.AB.BC.CD.D
【题目】实验室现有 Fe(OH)3、Cu(OH)2 和少量杂质的固体混合物,某同学欲测定该固体混合物中各成分的含量,设计了如下实验.部分实验步骤如下:
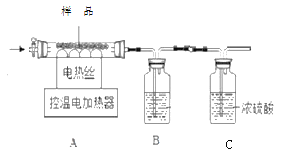
已知:①在 68℃时,Cu(OH)2 会分解;在 500℃时,Fe(OH)3会分解.二种物质的分解产物均为氧化物且化合价不变.
②装置气密性良好,试剂均足量,反应均完全,杂质不参与反应也不分解.
Ⅰ.将质量为m的样品放入硬质玻璃管中,称量装置B的质量.
Ⅱ.连接好装置。缓缓通入N2一会儿,再开始加热并控制温度在100℃左右.反应结束后称量装置B的质量.
Ⅲ.重复步骤Ⅱ,控制温度在550℃左右.反应结束后再次称量装置B的质量.实验数据记录如下表:
温度/℃ | 室温 | 100 | 550 |
B装置/g | m1 | m2 | m3 |
请回答下列问题:
(1)装置B中的试剂是______,装置C的作用是______。
(2)每次停止加热后仍需继续通N2,作用是可防止倒吸和______。
(3)写出步骤Ⅲ发生反应的化学方程式______。
(4)样品中Cu(OH)2的质量分数为______。若步骤Ⅱ中物质反应不完全,则样品中Fe(OH)3的质量分数会______(“偏大”或“偏小”或“无影响”)。
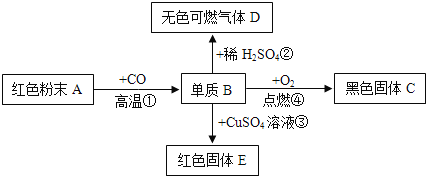
【题目】人类的生成生活离不开金属。
①铝片能压缩成铝箔是因为铝有良好的_____(选填“导电性”或“延展性”)。
②铁制品在喷漆前需除锈,可用来除铁锈的物质是_____。
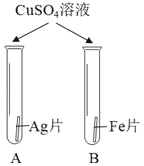
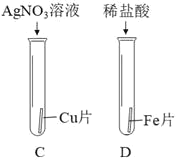
③为探究铁、铜、银三种金属的活动性顺序,设计了 I、II两种方案。
方案 I | 方案 II |
|
|
能验证三种金属活动性顺序的一种方案是_____,该方案中证明金属活动性Fe>Cu>Ag的实验现象是_____。