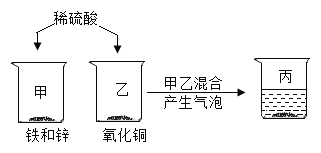
题目内容
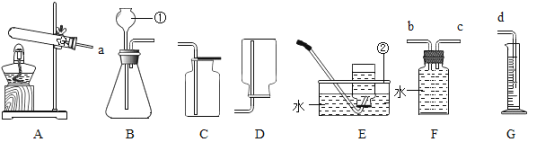
【题目】已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳;在空气中加热则生成氧化铁和二氧化碳。某化学兴趣小组用下图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量可吸收CO2)

实验步骤如下
I在硬质玻璃管加入质量为mg的碳酸亚铁样品,先打开K通入一氧化碳一段时间
II加热装置A中的固体样品直到固体质量不再减少后,停止加热
III继续通入一氧化碳直到装置A冷却到室温后关闭K。
已知实验中测得装置A中固体减少了a g,装置B中液体质量增加了b g。
回答下列问题:
(1)步骤I通入一氧化碳一段时间的目的是_________________;
(2)写出碳酸亚铁的化学式并标出铁元素的化合价________________;
(3)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B中质量增加且__________;
(4)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a ___b(填“﹥”“﹦”或“﹤”);固体样品碳酸亚铁的质量分数为___________;
(5)D处为收集尾气的装置,应选择_____________装置(填“甲”“乙”或“丙”)。
【答案】排出装置中的空气,防止加热时一氧化碳和空气混合可能发生爆炸 ![]() C中无明显现象 ﹤
C中无明显现象 ﹤ ![]() 乙
乙
【解析】
(1)步骤I通入一氧化碳一段时间的目的是排出装置中的空气,防止加热时一氧化碳和空气混合可能发生爆炸。故填:排出装置中的空气,防止加热时一氧化碳和空气混合可能发生爆炸。
(2)碳酸亚铁中,碳酸根化合价是-2,根据化合物中元素化合价代数和为零可知,铁元素化合价是+2,可以表示为![]() 。故填:
。故填:![]() 。
。
(3)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B中质量增加且C中无明显现象。故填:C中无明显现象。
(4)根据质量守恒定律,A中的质量减少是碳酸亚铁反应,最后变成铁,所以减少的质量是碳酸亚铁中的碳元素和氧元素的质量和,而装置B中增加的质量是二氧化碳的质量,二氧化碳中碳元素和氧元素,不但有碳酸亚铁中的,也有一氧化碳中的,所以装置B中增加的质量大于A中减少的质量;即a﹤b。设碳酸亚铁质量为x。
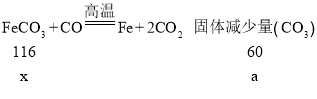
![]()
x=![]() 。
。
固体样品碳酸亚铁的质量分数为:![]() =
=![]() =
=![]() ,故填:﹤;
,故填:﹤;![]() 。
。
(5)由于尾气中含有一氧化碳,会污染空气,所以D处为收集尾气的装置,一氧化碳难溶于水,密度与空气相近,因此采用排水法来收集,收集时应导管短进长出,应选择乙装置。故填:乙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是___________________
(2)表中所列3种催化剂的催化效果最佳的是______________
(3)写出KClO3分解的化学方程式:_________________________
(4)由实验1和实验4可知,KCl____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____________
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内____________