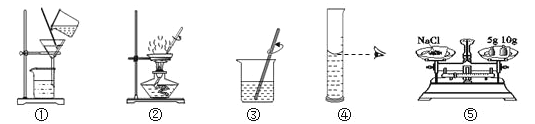
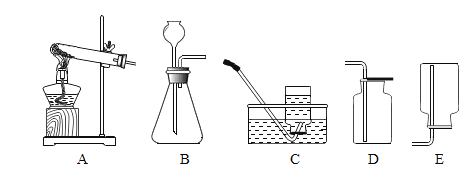
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A 配制160g 10%的氯化钠溶液 | B去除粗盐中的泥沙 |
(1)实验的主要步骤是:⑤→_____→③。 (2)溶解时,用玻璃棒搅拌的目的是_____。 | (1)实验的主要步骤是:③→_____→②。 (2)蒸发时,用玻璃棒搅拌的目的是_____。 |
可供选择的基本实验操作如图:
| |
【题目】如表是Na2CO3、NaCl的溶解度。
温度 | Na2CO3 | NaCl |
20℃ | 21.8g | 36.0g |
30℃ | 39.7g | 36.3g |
20℃时,向2只盛有100g水的烧杯中,分别加入30g两种固体,充分溶解。下列说法正确的是( )
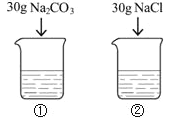
A. 烧杯①中溶质与溶剂的质量比为3:10
B. 烧杯②中溶质的质量分数为30%
C. 烧杯①中溶液升温至30℃,溶质质量分数不变
D. 烧杯①②中溶液升温至30℃(忽略水的蒸发),溶液质量①=②